診断を行う際に人工知能を使用することは、もうすぐです。 そして、思ったよりもさらに近い。 結局のところ、大西洋の両側にある2つの研究チームは、医学におけるAIの「ブラックボックス」の問題を解決することができました。
ブラックボックスの問題は、AIシステムが結果を提供する際に、医学ではさらなる治療を診断および推奨しているが、特に米国食品医薬品局(FDA)を必要とする根拠を提供していないことです。 。
昨年12月、マサチューセッツ総合病院(マサチューセッツ総合病院)は、頭蓋内出血の診断を「説明」するようAIに教えることができたと報告しました。 5か月前、2014年にGoogleに買収された英国の会社DeepMindは、眼疾患の診断における同様のブレークスルーを発表しました。
両チームの主なタスクは、スキャナーの画像を評価し、専門医が行うように意思決定を行うようシステムに教えることでした。
標識のアトラス
マサチューセッツ州病院の放射線科の医師は、ハーバード大学工学応用科学科の大学院生とともに、病院のウェブサイトのプレスリリースによると、頭蓋内出血を分類できるAIモデルを開発しました。 システムをトレーニングするために、チームは904 CTスキャン(コンピューター断層撮影)を使用しました。各CTスキャンには約40の個別の画像が含まれていました。 5人の神経放射線科医のチームは、出血自体の有無だけでなく、場所に基づいて出血の5つのサブタイプの1つが存在することを示すために、各画像にラベルを付けました。 このディープラーニングシステムの精度を高めるために、チームは、放射線科医による画像分析プロセスを模倣するアクションを統合しました。これには、コントラストや明るさなどのパラメーターを調整して隠れた違いを明らかにし、CTスキャンの隣接するセクションをスクロールして実際に何かが現れるかどうかを判断することが含まれます1つの画像で、実際の問題を反映しているのか、それとも歪みについて何も話していないのか。
システムモデルを作成した直後に、研究者は2つの別個のCTスキャンセットでテストしました。システムが開発される前に行われた頭蓋内出血のある100スキャンと、モデルの作成後に行われた出血のある79スキャンとなしの117スキャンです。 以前に撮影された最初のデータセットの場合、モデルは、放射線科医によって行われた分析レベルで頭蓋内出血の判定と分類において正確でした。 2番目のセットを分析することで、彼女はこの分野の専門家ではない人よりも優れている可能性があることを証明しました。
「ブラックボックス」の問題を解決するために、チームはシステムのチェックを行い、5つのサブタイプの出血のそれぞれの特徴的な症状を最も明確に表す画像をトレーニングデータセットから保存しました。 この特徴的なアトラスを使用して、システムは、CTスキャンの分析で使用されるものと同様の画像のグループを表し、決定が下された根拠を説明できます。
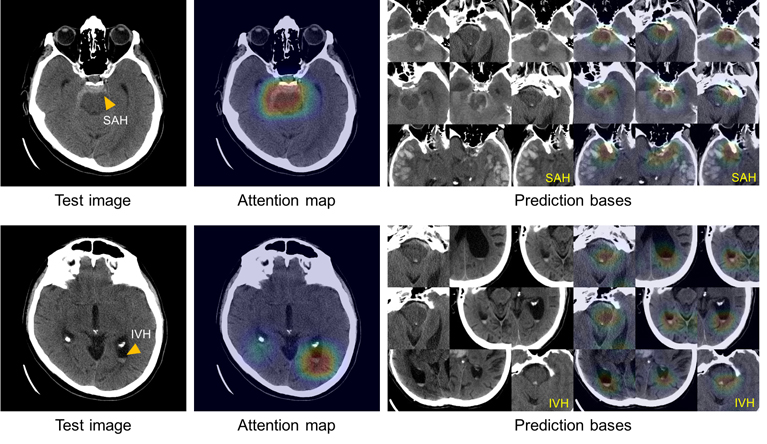
この図は、クモ膜下出血(左上)と脳室内(左下)の診断を説明するシステムの能力を示しており、システムをトレーニングするために使用された画像アトラスから同様の症状の画像(右)を示しています。
「頭蓋内出血の迅速な認識と、その後の急性脳卒中の症状のある患者の迅速な適切な治療は、重篤な健康影響を最小限に抑え、死を防ぐことができます」と、放射線科医のマイケル・レオ研究者は述べた。 -多くの研究室では、特に夜間または週末に特別に訓練された神経放射線科医がいないため、非専門家は患者の症状が出血によるものかどうかを判断する必要があります。 神経放射線科医によって訓練された信頼性の高い「バーチャルセカンドオピニオン」が利用可能になると、専門医ではない人の結果が改善され、患者が適切な治療を受けられるようになります。
組織セグメンテーションマップ
2018年8月、英国の会社DeepMindは、Nature Medicineリソースに関する研究を発表しました。この研究では、専門医療レベルで行動できるAIモデルを開発することで「ブラックボックス」問題を解決したと述べましたが、治療プロセスから人々を除外するわけではありませんが、上記の場合のように、医師がより効果的になるのを助けます。
発表された研究によると、DeepMindチームは、眼疾患の分野でMoorfields Eye Hospitalと眼科疾患との闘いのセンターと連携して働き、 光干渉断層法 (OCT)の3D画像の診断モデルを開発しました。 連携して動作する2つの独立したニューラルネットワークを作成することで、「ブラックボックス」を開くことができました。 最初の3次元畳み込みアーキテクチャ(U-Net)を使用したセグメンテーションでは、生のOCTスキャンを眼組織のセグメンテーションマップに変換します。 トレーニングには、877の臨床OCTスキャンを使用しました。各スキャンには128のセクションがあり、3つの代表者のみが手動でセグメント化されました。 セグメント化ネットワークは、さまざまな症状(出血、限局性病変など)を検出し、マップを作成します。 同社のブログで、Applied AIの責任者であるMustafa Suleimanによれば、これは検眼医がシステムが「考える」方法にアクセスするのに役立ちます。
2番目のニューラルネットワークは、提案されたマップを分類、分析し、診断と治療の推奨事項を治療スタッフに提供します。 開発者は、ネットワークが推奨値をパーセンテージで表示することが基本的に重要であり、医師が分析でシステムの「信頼性」を評価できるようにすることが重要であると考えています。 「患者が受ける治療を決定する際に検眼士が重要な役割を果たすため、この機能は重要です」とMustafa Suleiman氏は言います。 彼によると、このシステムの重要な特徴は、それが実際に役立つことであり、医師がAIの推奨事項を注意深く研究する機会であるということです。 このシステムは、糖尿病性網膜症、加齢性黄斑変性症、その他数十の疾患の診断を加速することにより、視力の完全な喪失を防ぐように設計されています。

イラストの説明。 複雑なセグメント化および分類ネットワークを使用した計算の取得。 この図は、セグメント化されたネットワークの5つのサンプルと分類ネットワークの5つのサンプルの複合体を使用して、1回のスキャンで25の予測を作成する方法を示しています。 各サンプルセグメントネットワークは、最初に、調査対象のOCTに基づいて仮定のセグメントマップを提供します。 5つの仮定それぞれについて、分類ネットワークのパターンは各マーカーの確率を提供します。 ここでは、萎縮の場所のマーカーが詳細に示されています。
両方の研究チームは、彼らが開発したシステムが医師に取って代わるものではないが、意思決定をより効果的にするのに役立つこと、つまり、より多くの患者を短期間で支援することを期待しています。 次のステップは、病院のスキャナーで開発を直接使用することです。