ケンブリッジ大学の癌および老化における細胞老化会議で、細胞老化の定義は次のように定義されました。「 細胞老化は、癌遺伝子の活性化や過剰な細胞分裂を含むさまざまな分子トリガーによって引き起こされる増殖の終了です。 さらに、老化細胞は、免疫能のある細胞を含む近隣の細胞の機能に影響を与える、多くのストロマ調節因子および炎症調節因子(いわゆる「セロトーレ表現型の老化に関連する」)の分泌によって特徴付けられます。 多くの説得力のある事実は、細胞の老化が腫瘍の成長を抑制するための効果的なメカニズムであることを示しています。 同時に、細胞の老化は組織や生物全体の老化の一因となる可能性が高い 。」
さまざまな原因メカニズムにより、3種類の細胞老化が区別されます。
前世紀の60年代初頭の最初は、細胞複製老化が発見された。 すでに有名な研究で、アメリカの老年学者L. HayflickとP. Moorheadは、培養ヒト線維芽細胞の実験で、細胞は無期限に分裂せず、細胞分裂には限界があることを確立しました(後にHayflick限界または限界と呼ばれます)[1]。 10年後、ソビエトの生物学者Alexei Olovnikovがこの現象について論理的な説明を行い、細胞分裂の限界とDNAの末端部分、テロメアの漸進的な短縮を結び付けました。 これは、テロメアの短縮後にテロメアを増加させることができるテロメラーゼ酵素が、ほとんどの体細胞で活性がないという事実によるものです。 テロメアが臨界レベルまで短縮されると、DNA損傷応答(DDR)が発生し、その結果、細胞周期が停止し、細胞が老化します。 健康と長寿に悪影響を与える外部要因(肥満、運動不足、ストレス)もテロメア短縮にマイナスの影響を与えることが知られています[2]。 また、テロメア長の短縮の加速は、アルツハイマー病などの神経変性疾患の患者で観察されます[3]。
ほとんどの細胞では、Hayflickの限界は約50分裂であり、その後細胞は分裂しなくなると考えられています。 体全体の老化と細胞老化を区別するために、HayflickとMoorheadは科学革命に特別な用語を導入しました。これは細胞老化-老化(老化-老化とは対照的)を指します。
複製老化に加えて、細胞老化は、テロメアの長さに関係なく、細胞老化を時期尚早に誘発する他の要因によって引き起こされる可能性もあります。 これらの要因は、2番目と3番目のタイプの細胞老化を構成します。
したがって、RASやRAFなどのがん遺伝子の活性化は、がん遺伝子誘導老化(OIS)と呼ばれる細胞の老化を引き起こします。 この形態の細胞老化は、腫瘍抑制に関連しています。 複製とOISの老化を伴う細胞のゲノム比較研究は、増殖する細胞と比較してこれら2種間で遺伝子発現に一般的な変化がありますが、有意差もあることを示しています[4]。 活性酸素種(ROS)に関連するDNA損傷は、OISの老化のメカニズムに大きな役割を果たすことが知られています。 ERKキナーゼはOISの発生にも積極的に関与しており、細胞周期の進行に必要なタンパク質の分解を刺激します。 このタイプの細胞老化におけるDNA損傷応答(DDR)の役割は明らかにされていません。 H-Ras G12Vなどの変異がん遺伝子は、DNA損傷に関係なく、p38 MAPKキナーゼおよびNF-kB転写因子に関連する細胞老化の分子経路を活性化する可能性があることが知られています。 発癌性Ras遺伝子は、DNA損傷に関係なく、p19ARFおよび細胞老化を介したp53のアップレギュレーションにも寄与します。 [5]。 したがって、細胞のOIS加齢の刺激は、DNA損傷がなくても除外されません。
テロメアの長さにも依存しない3番目のタイプの細胞老化は、ストレス誘発性の早期老化(SIPS)です。 それは様々な性質のストレス要因に反応して起こります:イオン化と紫外線、ROSのレベルの増加、化学療法薬。 OISエージングとは異なり、SIPSの発生はDNA損傷(DDR)への応答に完全に依存しています。 表現型的には、SIPSと複製細胞の老化はほぼ同じですが、タンパク質の発現レベルが異なる場合があります。 体全体の老化におけるSIPSの役割は完全には明らかではありません-SIPSの発生の主な要因である抗酸化物質の発現の増加とROSの抑制は、寿命の延長につながりませんでした[6]。
老化細胞の細胞周期停止の分子メカニズムは、今日活発に研究されています。 DNA損傷の程度は、さまざまな方法で細胞周期に影響を与えることが知られています。 したがって、中程度のDNA損傷は一時的な成長停止を引き起こし、広範なDNA損傷はプログラムされた細胞死を引き起こし、持続的なDNA損傷は細胞の老化を引き起こします。 一時的な成長停止からサイクルの不可逆的停止への移行を支配する分子決定要因(主要な要因)は複雑であり、まだ完全には説明されていません。 DNA損傷は最初にp53-p21経路を活性化し、細胞周期を停止させることが知られています。 その後、DNA損傷が修復されない場合、細胞はアポトーシスを起こすか老化します。 2番目の場合、重要な役割はp16 INK4aタンパク質によって果たされ、pRb-E2Fシグナル伝達経路(網膜芽細胞腫タンパク質、pRb –E2F転写因子)による細胞周期停止の長期保存とクロマチン構造の変化を調節します[7]。
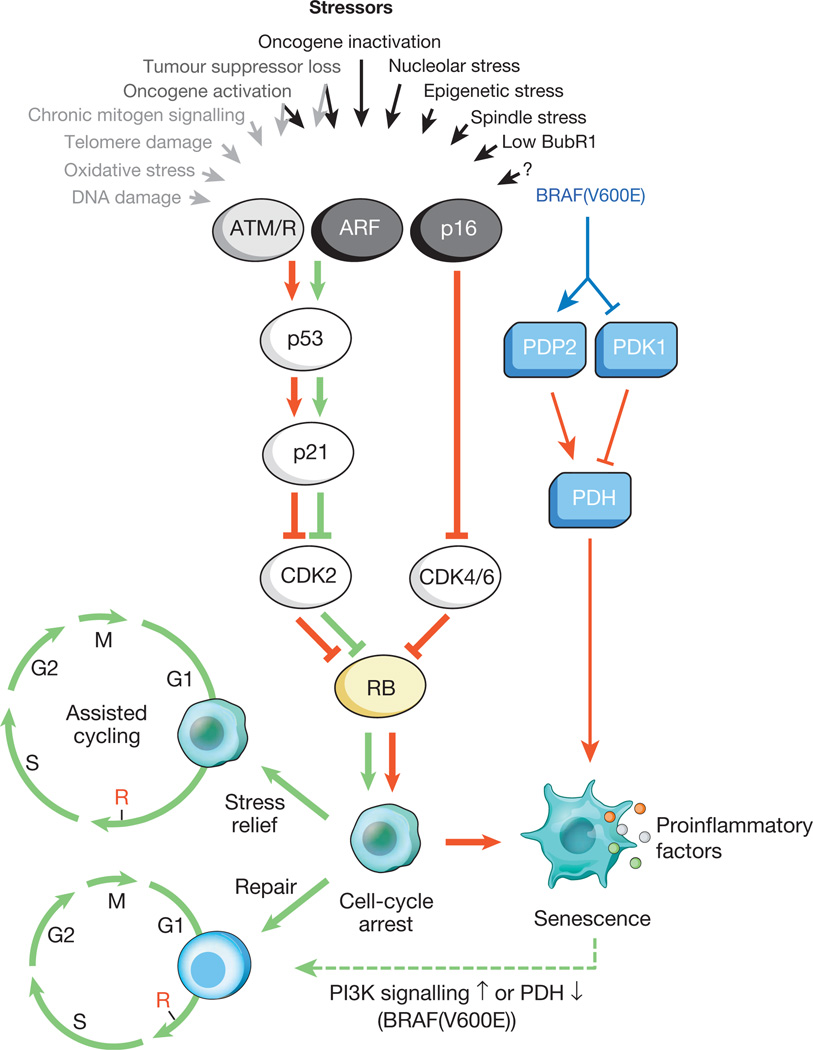
図1 細胞老化インセンティブと主要なエフェクター経路
さまざまな細胞内および外部ストレスが細胞老化プログラムを活性化する可能性があります。 これらのストレッサーはさまざまな細胞シグナル伝達カスケードを捕捉し、最終的にp53およびp16 INK4aを活性化します。 DDRを介したp53シグナル伝達を活性化するストレスの種類は、灰色のテキストと矢印で示されています(ROS(ROS)はDNA損傷応答(DDR)を引き起こし、遺伝子転写とDNA複製を破壊し、テロメアを短縮します)。 活性化されたp53はp21を誘導し、サイクリンE-Cdk2を阻害することで一時的な細胞周期停止を引き起こします。 p16 INK4aも細胞周期の進行を阻害しますが、サイクリンD-Cdk4およびサイクリンD-Cdk6複合体を標的とすることで阻害します。 p21とp16 INK4aは両方ともRbの不活性化を防ぐ働きをし、S期の開始に必要なE2F標的遺伝子の抑制を続けます。 深刻なストレス(赤い矢印)の下で、一時的にブロックされた細胞は細胞周期の停止段階に入ります。 軽微な損傷を受けやすい細胞は正常に回復し、通常のサイクルを再開できます。 したがって、p53-p21経路は、ストレスの種類とレベルに応じて、老年期にp16 INK4aと拮抗または相乗作用することができます。 BRAF(V600E)は、代謝エフェクター経路を介した老化に関連しています。 BRAF(V600E)は、PDP2を誘導し、PDK1の発現を阻害することによりPDHを活性化し、解糖から酸化的リン酸化への移行を促進し、老化酸化還元ストレスを引き起こします。 加齢を受けている細胞は、加齢に関連する誘発ストレスに関係なく炎症性転写物を誘発します(色の付いた点はさまざまなSASP因子を表します)。 赤と緑の矢印は、それぞれ老化と「アンチエイジング」を促進する活動を示しています。 破線の緑色の矢印は、「経年変化」メカニズムを示しています。
老化細胞は、微小環境(周囲の組織)に積極的に影響を与え、多くの活性分子を分泌することが知られています:炎症性サイトカイン、ケモカイン、成長因子、プロテアーゼ(合計約40種類の分子)。 これらの物質は、単一のグループに結合されました-細胞老化に関連する老化関連分泌表現型(SASP)。 SASP因子は、胚発生における組織リモデリングに積極的に関与していることが知られています。 さらに、彼らの影響下で、母親の体と胚の両方が再構築されます。 SASPの進化的性質は、多くの防御メカニズムと関連していると考えられています:腫瘍抑制、外傷からの回復、および組織再生。
SASPの単純化された生理学的効果は、次のように説明できます。 分泌された炎症誘発性分子は、除去される老化細胞の周囲に炎症の焦点を形成します。 老化した細胞を排除するために免疫系の細胞をこの場所に引き付けるもの。 SASPマトリックスマトリックスメタロプロテアーゼ(MMP-1、MMP-10、MMP-3)およびセリンプロテアーゼは細胞外マトリックスを再構築して、免疫系の細胞の老化細胞への浸透を促進します。 そして最後に、分泌された成長因子は、隣接する細胞の増殖を刺激して、遠隔の老化細胞を置き換えます。
若くて健康な身体において、SASPメカニズムがどのように正常に機能するかが説明されています。 しかし、年齢や逸脱により、その有効性は大幅に低下する可能性があり、これは組織内の老化細胞の蓄積を引き起こし、その結果、SASP炎症促進因子の長期にわたる分泌を引き起こします。 慢性炎症の病巣の発生を伴います。 さらに、長期のSASP活動が正常な細胞の感染症として作用することが知られています。 老化細胞によって分泌された活性分子は細胞外空間に入り、隣接する正常細胞に作用して、細胞周期停止と増殖停止を開始します。 組織の細胞老化の発達を大いに加速します。
さらに、老化細胞によるSASP因子の長期にわたる分泌は、加齢に伴う病態の発症と関連しています。 したがって、老化細胞によるマトリックスメタロプロテアーゼの分泌の増加は、冠状動脈性心臓病、骨粗鬆症および変形性関節症の発症を刺激します。 老化した平滑筋細胞は、多数の炎症誘発性サイトカインの分泌を介して、アテローム性動脈硬化の発症に関与しています。 老化T細胞による炎症誘発因子TNF-αの長期分泌は、骨機能不全に関連するプロセスに関与しています。 さらに、炎症性IL-6レベルの増加は、インスリン抵抗性、糖尿病、アテローム性動脈硬化症、および肝疾患に関連することが知られています。 SASP因子が重要な役割を果たす全身の慢性炎症と老化に関連するこれらすべてのプロセスを参照するために、炎症という特別な用語が導入されました。 さらに、発癌におけるSASPの二重の役割が報告されています-その腫瘍抑制および腫瘍促進活性[8]。
老いも若きも上記の細胞老化の二重の役割に関連して、一部の科学者は細胞老化を進化的拮抗的多面発現の例と見なし、「今すぐ使う-後で支払う」というフレーズでユーモラスに定式化されています。 この理論によると、若い生物の生存率を高めるために進化に定着したプロセスは、高齢者に累積的な有害な影響を与える可能性があります。 したがって、若い年齢の老化細胞に関連するメカニズムは、妊娠、損傷からの回復、および腫瘍に対する保護に関与しています。 後の年齢では、同じメカニズムが全身性炎症、組織変性、および病状の発生を引き起こします[9]。
老化した体細胞のプールの中で、SENSコンセプトの著者は、脂肪組織に関連する2つの種を明確に区別します。前脂肪細胞と内臓脂肪組織細胞です。 そして、今日では内臓脂肪が代謝的に活性であり、アディポカインである多くの活性分子を放出することが知られているため、これは偶然ではありません。 これは、多くの加齢関連の病状(インスリン抵抗性、糖尿病、心血管疾患)の発症に関連しています。 SENSの著者は、加齢に伴う免疫系の悪化にも注目しています。 彼らの意見では、これは老化細胞による身体の過負荷と、答えとして、老化細胞を破壊して他のタイプの免疫細胞を損なうTキラーの過剰生産によるものです。 老化体をさまざまな感染症に対して脆弱にするもの。
老化細胞の蓄積の問題の解決策は、SENSによって2つの方向に見られます。 1つは、古い細胞に毒性のある、またはアポトーシスを引き起こすが、健康な正常細胞には無害な薬物の開発です。 2番目の方向は、老化した標的細胞を選択的に検索して殺すための免疫系の刺激薬の検索です。 SENS開発者によると、これらの異常な細胞を選択的に攻撃する最も可能性の高い方法は、表面にある独特の分子を使用することです。 実際、細胞の種類によって表面に違いがあります。 したがって、最初のステップは、除去する老化細胞に固有の細胞表面マーカーの識別と方向付けです。 この戦略は抽象的ではありませんが、細胞増殖をブロックし、免疫細胞を誘引してそれらを破壊するいくつかの癌治療の基礎をすでに形成しています[10]。
研究は、老化細胞が実際に様々な組織に年齢とともに蓄積することを示しました[11]。 急速に老化するマウスのモデルに蓄積する老化細胞を除去すると、3つの主要な老化表現型(白内障、サルコペニア、皮下脂肪の損失)の出現が防止されることも説明されました[12]。 これに関して、細胞老化の信頼できる効果的なバイオマーカーを特定する必要があることは非常に明白です。 そもそも潜在的な老化細胞破壊薬の効果を追跡するために必要です。
ほとんどの場合、老化に関連するベータガラクトシダーゼであるSA-β-Galは、老化細胞のバイオマーカーとして使用されます。 酵素β-ガラクトシダーゼは、それを含む化合物(ラクトース、硫酸ケラチン、スフィンゴ脂質など)から末端のβ-ガラクトースを分解するリソソーム加水分解酵素です。 1995年には、老化細胞でSA-β-Galの発現が著しく増加したことが報告されました。 免疫組織化学的手法を使用して、老化した組織の含有量を決定します。 細胞内のSA-β-galの活性を測定するための代替方法として、基質として5-ドデカノイルアミノフルオレセインジ-β-D-ガラクトピラノシドを使用するフローサイトメトリーが使用されます。
しかし、細胞老化のバイオマーカーとしてのSA-β-Galの使用には、この酵素が偽陽性を与え、老化細胞だけでなく、さまざまな理由で増殖が制限される「若い」細胞でも発現を増加させるため、独自の制限があります。 したがって、今日では、SA-β-Galを他の細胞老化マーカーと併用することが望ましいと考えられています。
2017年、イスラエルの細胞診は、ImageStreamXサイトメーターを使用したフローサイトメトリーに基づいた、より効率的な新しい技術を開発しました。 この方法により、80%以上の効率で組織内のSA-β-Galを検出できました。 分析の効率を高めるために、科学者はSA-β-Galとともに、細胞老化のバイオマーカーであるHMGB1およびγH2AXをさらに決定しました。 HMGB1は核非ヒストンタンパク質HMGのグループからのタンパク質であり、老化細胞では核を離れて細胞外空間に移動します。 ヒストンH2AXのリン酸化型であるγH2AXは、初期のDNA損傷と細胞老化のマーカーとして認識されています。 さらに、イスラエルの科学者による新しい方法により、サイズの増加により老化細胞を特定することが可能になりました。 研究者によると、彼らの技術は、組織から老化細胞を除去するために特別に設計された新しい医薬品化合物の有効性を迅速に判断するために使用できます。 [13]。
細胞老化に関連するヘテロクロマチン病巣(SAHF)も、老化の別のバイオマーカーである可能性があります。 SAHFは、老化細胞の核に形成される特殊なヘテロクロマチン構造です。 それらの形成は、この部位に位置する細胞周期に関与する遺伝子(MCM3、PCNA、サイクリンA)の不活性化に関連する不可逆的なヘテロクロマチン化に関連しています。 SAHFは、特殊なDAPI色素で染色した後、顕微鏡で見ることができます。 さらに、老化細胞における前骨髄球性白血病タンパク質(PML)の発現増加が報告されており、これは細胞老化の追加マーカーにもなります[14]。
アメリカの研究者は、細胞の老化のバイオマーカーとして、ヒト末梢血T細胞のp16 INK4aタンパク質を説明しています。上記のように、p16 INK4aは老化細胞の細胞周期の停止に積極的に関与しています。 p16 INK4aの発現は老化細胞で増加し、判明したように、喫煙と身体的不活動に有意に関連していました。さらに、p16 INK4aの発現は、加齢に伴う炎症のマーカーである血漿IL-6の濃度と関連がありました。科学者によると、p16 INK4aの発現は、細胞の老化を判定するための容易に測定可能な末梢血バイオマーカーです[15]。
付録1.
細胞老化のバイオマーカー。
1.細胞の老化に伴うβ-ガラクトシダーゼ(老化に関連したβ-ガラクトシダーゼ、SA-β-Gal)。
2.タンパク質HMGB1(高移動度グループのタンパク質B1)。
3.リン酸化ヒストンγH2AX。
4.細胞老化ヘテロクロマチン病巣(SAHF)に関連。
5.タンパク質前骨髄球性白血病(PML)。
6.タンパク質p16 INK4a。
著者:アレクセイ・ルジェシェフスキー。
参照資料
1. L.HayflickP.S.Moorhead. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. Neurobiol Aging. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. エージングセル。 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. エージングセル。 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. エージングセル。 2009 Aug; 8(4): 439–448.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. Neurobiol Aging. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. エージングセル。 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. エージングセル。 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. エージングセル。 2009 Aug; 8(4): 439–448.