最初の部分へのリンク(自然免疫)
そのため、身体に侵入したものは敵対的なものとして認識され、破壊されました。 しかし、病原体は検出を妨げるマスキングシステムを開発する可能性があるため、一般的な非特異的な兆候によって無関係のエンティティを識別するたびに、行動の最適な概念とはほど遠い。 これらの微生物を検出する(および他のすべての微生物に対する応答の有効性を高める)ために、抗体を産生するTリンパ球およびBリンパ球を含む特定の(獲得した)免疫系が生じました。
アンチウイルスデータベースの形成と設計
T細胞。
Tリンパ球は、T細胞受容体(TCR-T細胞受容体)-細胞の表面にある特別なタンパク質分子を使用して、外来物質を認識できます。 これらの受容体は、外来タンパク質と直接相互作用することはできません-前のセクションですでに説明した主要組織適合遺伝子複合体(MHC)分子にタンパク質フラグメントを結合する必要があります。 このような一見奇妙な解決策がなぜ解決されたのかを以下に説明します。
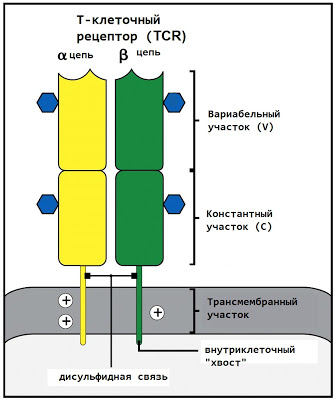
T細胞受容体は2つのペプチド鎖(αとβ)で構成され、それぞれは細胞の細胞質に位置する一方の端にあり、細胞の奥深くに信号を送ることができ、もう一方は(細胞間空間で議論されます)。
各TCRチェーンの外側の端は、2つのフラグメントで構成されます-端の変数(V)と膜に近い定数(.C)。 定常領域はすべてのヒトTリンパ球で同じですが、可変領域はさまざまです。
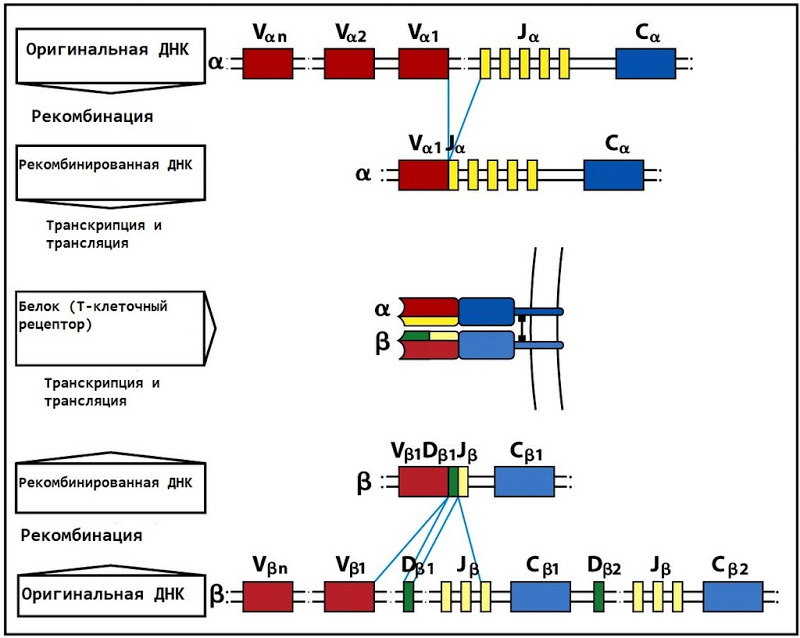
可変領域は、2つの(α鎖の場合-VおよびJ)または3つの(β鎖の場合-V、DおよびJ)DNAセクションによってエンコードされます。 さらに、ゲノムには50以上の異なるVフラグメント、2 Dおよび平均40(αが13、βが61)のJフラグメントがあります。 T細胞が骨髄で形成されると、V、D、およびJフラグメントが既存のヒープからランダムに選択されます。 さらに、エントロピーを導入するためのさらに微妙なメカニズムがいくつかあります。したがって、結局のところ、可能なTCRの総数は約10 ^ 18です。
このようにして形成されたT細胞は骨髄を出て胸腺に送られ、そこで既存の抗原に微調整されます。 ランダムに形成された受容体は周囲の組織を脅かす可能性があるため、この段階では、リンパ球はまだ活動していません。
胸腺の微調整は、一度に複数の方向に進みます。 これらの最初のものはポジティブセレクションです。 T細胞はそこに位置する抗原提示細胞(APC)と相互作用を試みますが、その表面にはMHC分子が存在します。 T細胞がMHCに接着できない場合、そのような細胞は分裂しません。 可能であれば、そのようなケージは子孫を生成します。
2番目はネガティブ選択です。 胸腺では、たんぱく質が体全体(たとえばインスリンを含む)から生成されますが、APCの表面にタンパク質を提示するためだけです。 T細胞がそのようなタンパク質を認識すると、すぐに破壊されます。 根絶プロセスのエラーは通常、自己免疫疾患につながります(インスリンの場合、1型糖尿病)。

これで、T細胞にMHCが必要な理由が明らかになり始めます。 T細胞と抗原の最初の接触のプロセスは制御されなければなりません。さもなければ、それは体組織に脅威を与え始めるかもしれません。
したがって、ランダムに形成されたT細胞のヒープから、ポジティブおよびネガティブ選択により、MHCに付着したタンパク質を認識でき、組織にとって安全なリンパ球のセットが得られます。 その後、これらの細胞はリンパ節に送られ、そこで活性化されます。
Tリンパ球の活性化は、これらの細胞が実際に機能を実行できるようになるプロセスです(ウイルスに感染した細胞を破壊するか、B細胞およびマクロファージを活性化します)。 リンパ節には、感染部位で感染性病原体を吸収し、それをタンパク質に分解し、その表面に対応するタンパク質を提示する膨大な数の樹状細胞があります。 その後、Tリンパ球がこのタンパク質を認識できる場合(つまり、その受容体がそれに適している場合)、Tリンパ球は「オン」になります。 したがって、外来タンパク質を本当に認識するリンパ球のみが活性化されます。
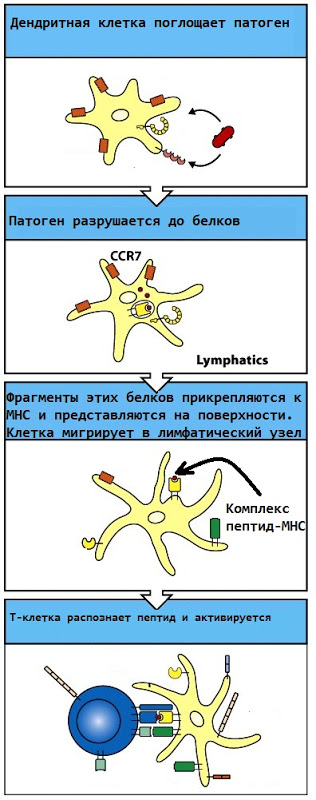
活性化後、Tリンパ球は分裂することができ(クローン拡大)、所定の位置にあるリンパ球の新たに作成されたコピーが活性化され、血流に入るか、リンパ節の別のゾーンに移動し、B細胞の活性化に関与します。
B細胞
奇妙なことに、一般に、それらはTリンパ球に非常に似ています。 主な認識ツールであるB細胞受容体は、本質的に細胞の表面に付着した抗体です。 それでは、抗体の構造を見てみましょう。
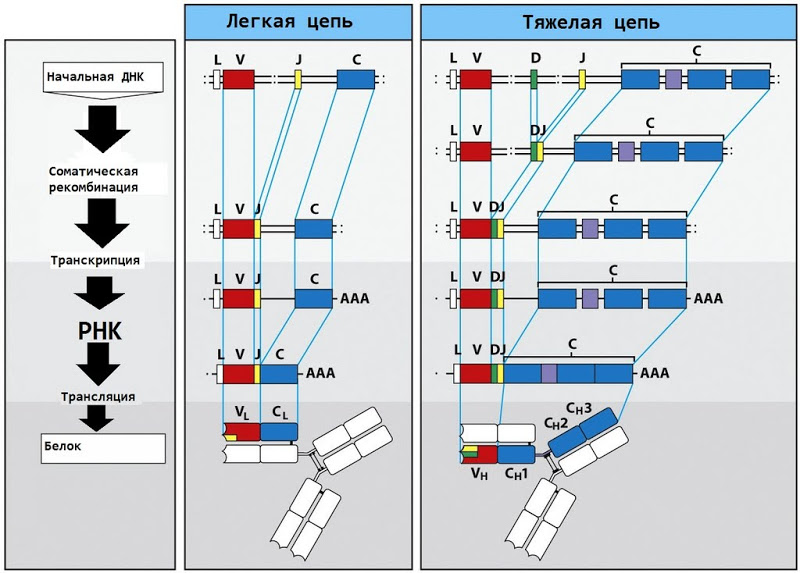
基本的なIgM抗体(免疫グロブリンM)は、2つの重鎖と2つの軽鎖で構成されています。 T細胞受容体の鎖のような各軽鎖は、可変領域と定常領域で構成されています。

可変領域エントロピー生成メカニズムは、TCRメカニズムに似ています。 40個のVフラグメントと5個のJフラグメントがあり、それらに多数のランダムな変異を追加すると、膨大な数の異なる抗体が生成されます。
Tリンパ球とBリンパ球の根本的な違いは、選択と活性化のメカニズムにあります。 B細胞は典型的なポジティブおよびネガティブ選択を受けません。 自動活動の脅威を避けるために、Bリンパ球はT細胞選択を使用します。
骨髄を出た後、B細胞はリンパ節に直接送られます。 途中で、彼らはそれらの受容体でいくつかのタンパク質を捕獲し、それらを吸収し、MHC分子に結合した表面にそれらを提示することができます。
B細胞を活性化するには、T細胞と相互作用する必要があります。 この相互作用により、Tリンパ球はBリンパ球の表面のMHCタンパク質複合体を認識し、認識が行われるとBリンパ球を活性化します。 これを行うことができるTリンパ球はネガティブ選択の過程で除去されたか、または活性化されなかったため、無効または自己反応性B細胞が単に活性化されないことに気付くのは難しくありません。

活性化後、B細胞は体細胞超変異と呼ばれるプロセスを経ます。 頻繁に分裂し始め、各分裂で、抗体の可変領域をコードするDNAの領域に新しい突然変異が導入されます。 明らかに、抗原をよりよく認識しているB細胞はより頻繁に、そして活発に活性化されます、そして我々は得ます...そうです、通常の自然selection。 最終的にB細胞を作成し、その抗体はある種の抗原を理想的に認識します。
最終的に、Bリンパ球はプラズマ細胞になり、工業規模で抗体を産生し始め、脅威が過ぎた後、かなりの期間後に適切な抗体を産生できる記憶細胞になります。
したがって、人体の「アンチウイルスベース」の生成はランダムに発生しますが、ヒューリスティックなメカニズムによってすでに認識されている病原体に対する有効性を示したシグネチャのみがアクティブになり、実際に使用されます。
「敵または敵」システム。 MHCの役割
マクロファージとは異なり、病原体を単に貪食するプロの食細胞、リンパ球はこれが可能であり、これは彼らの機能ではありません。 B細胞は抗体を分泌することにより影響を及ぼし、T細胞は他の細胞と相互作用することにより影響を及ぼします。
すべてのT細胞は条件付きで3つのタイプに分類できます:Tキレット、TヘルパーおよびTサプレッサー。 Tサプレッサーについては、次のいずれかの部分で説明します。
Tキラーは、細胞内の病原体(ウイルスまたは細菌)を破壊するように設計されています。 これらの目的のために、TCRに加えて、表面に隣接するCD8分子を運び、TCRとCD8が一緒にI型MHC分子を認識します。
MHC Iは、体内のすべての細胞の表面で生成されます。 それらが存在しない場合、細胞はナチュラルキラー(NK細胞)によって殺されます。 細胞内にあるすべてのタンパク質はMHC Iに付着します。 T-キラーはそれらに応答しません(ネガティブ選択のため)。 ただし、細胞内に病原体が出現した場合、表面にも提示され、Tキラーによって認識される可能性が高くなり、細胞と内部の泥が破壊されます。
MHC IIは別のケースです。 それらは抗原提示細胞(マクロファージ、樹状細胞、B細胞)のAPC表面にのみ見られ、TヘルパーはCD8と同様のCD4分子を使用してそれらを認識します。
細胞の細胞質にあるタンパク質がMHC Iに付着すると、外部から細胞に吸収されたタンパク質がMHC IIに付着します。 したがって、APCの表面にあるタンパク質は、「検索されている」一種のボードです。 Tヘルパーは、樹状細胞との接触後に最初に自身を活性化し、次にB細胞(抗体を産生し始める)およびマクロファージ(細菌をより積極的に貪食し始める)を活性化します。

結果として得られるシステムは、細胞と細胞内の両方に存在する感染性病原体の大部分を認識することができます。 さらに、彼女は明らかに非効率な細胞のコピーに余分なエネルギーを費やさず、自分の組織を攻撃しません。
この重いテキストを最後まで読むことができた人々への注意と底なしの敬意に感謝します:)