エントリー。
老化は、体内および外的損傷への順応の漸進的減少または喪失を伴う、身体の生物学的機能の生理学的減少として定義されます。 ヒトでは、老化の表現型は非常に不均一であり、いくつかのランダムな環境イベント、生涯を通じて蓄積された遺伝的およびエピジェネティックな変化の相互作用から生じる複雑なモザイクとして説明できます。 その巨大な複雑さにもかかわらず、老化の分子基盤は、身体の維持と回復に関与するいくつかの高度に進化的に保守的な生物学的メカニズムによって制限されています(1)。
過去30年間、老年学で最も話題になっているトピックの1つは、長寿の調節における成長ホルモン(GH)/インスリン様成長因子-1(IGF-1)/インスリンシステムの役割です。 蓄積されたデータは、この経路が癌、認知症、心血管疾患、代謝疾患などの多くの加齢性疾患の病因に重要な役割を果たすことを示しています(2-4)。
動物モデルでは、GH / IGF-1 /インスリンシステムの阻害により、寿命が大幅に延びることが示されています。 ただし、人間ではデータは矛盾しています(5、6)。
このレビューでは、IGF-1システムの研究と寿命の調整における最近の進歩について説明します。カロリー制限中に100歳以上の動物で観察される内分泌および代謝の適応は、より遅いために平均余命を延ばす生理学的戦略であると仮定します細胞の成長/代謝、信号伝達のより良い制御と生理学的予備能、および老化細胞の蓄積の減少。
IGF-1システムと動物モデルの耐久性
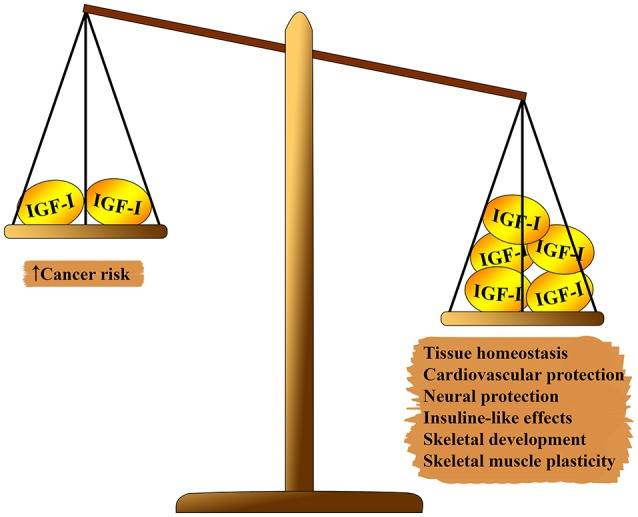
図1 体に対するIGF- 1の 多面的効果。 体重の片側では、組織の恒常性、心臓保護および神経保護の効果、インスリンのような効果、骨格の形成への関与および筋肉の再生を上回ります。 バランスの第二の側面:発がんのリスク。
IGF-1システムには、生物学的老化に対するいくつかの多面的効果があります(図1を参照)。 IGF-1は、胎児の発達、小児期および青年期の成長、および成人組織の恒常性において重要な役割を果たします。 さらに、IGF-1は、明らかに、アテローム保護効果、神経保護およびインスリン様効果(高濃度)を持ち、骨代謝と筋肉再生を調節します。 それにもかかわらず、IGF-1は、主に細胞周期の調節、アポトーシス、細胞の生存による強力な増殖活性のため、いくつかの種類の腫瘍の発生における主要な危険因子です(7-9)。 これらの効果のほとんどは、インスリン受容体基質(IRS)-1および-2との相互作用およびPI3K / AKT /哺乳類ラパマイシン標的経路(mTOR)の調節によって媒介されます(図2を参照)。
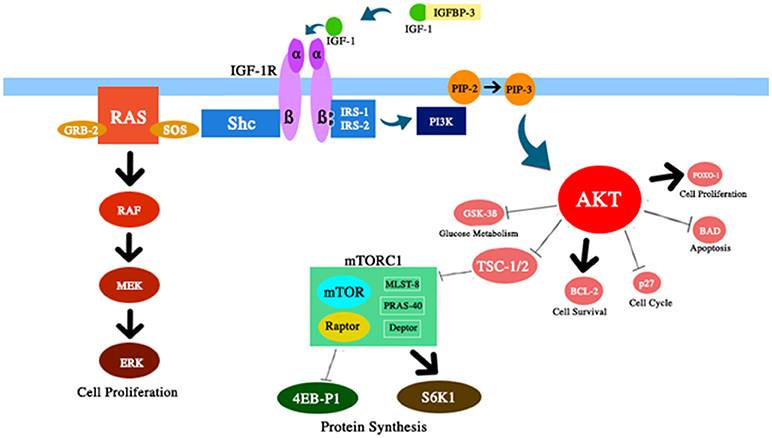
図2 このレビューで説明したIGF-1 / PI3K / AKT / mTORパスのいくつかのコンポーネントの概略 図 。 IGF-1は、細胞の生存と増殖、グルコース代謝、タンパク質合成に対応する効果でAKT活性を高めます。
いくつかの前臨床研究では、GH / IGF-1 /インスリンシグナル伝達経路を制御する遺伝子の変異が無脊椎動物と脊椎動物の両方の動物モデルの寿命を大幅に延長できることが報告されています(5、6)。
無脊椎動物モデル。
無脊椎動物では、インスリン/ IGF様カスケードは、1つの一般的なインスリン/ IGF-1様受容体と相互作用できるいくつかのペプチドによって調節されています。
線虫Caenorhabditis elegansでは、インスリン/ IGF様経路は、daf-2、age-1遺伝子(触媒サブユニットPI3Kをコードする)、akt-1、akt-2、pdk-1、sgk-1(セリン-スレオニンキナーゼ)によってコードされるいくつかのタンパク質で構成されます)、daf-16、skn-1およびdaf-18(PTEN、AKTシグナル伝達経路の阻害に関与するホスファターゼ)。 daf-2、age-1、akt-1、akt-2、pdk-1、sgk-1遺伝子の活性の低下がこの経路を抑制することが示されており、これらの変異を有する動物はよりゆっくりと加齢し、寿命が延びることが報告されています300%まで。 対照的に、インスリン/ IGF様経路の刺激は、線虫の寿命を減少させます(10、11)。
ショウジョウバエのキイロショウジョウバエでは、インスリン/ IGF様シグナル伝達はdINR(インスリン受容体様タンパク質/ IGF-1)、CHICOインスリン受容体基質、PI3K Dp110 / p60、およびPK3 PI3Kターゲットで構成されています。 これらの遺伝子に変異を持つハエは、平均寿命を有意に延長することが報告されました(12、13)。
驚くべきことに、異なる組織における同じ分子メカニズムは同じ方法で老化に影響を与えません。 線虫およびショウジョウバエのいくつかの研究は、神経および脂肪組織におけるインスリン/ IGF様シグナル伝達の減少が寿命の調節に重要な役割を果たすことを示しています(14、15)。 このカスケードは長寿の調節に重要であることが無脊椎動物モデルで示されていますが、インスリン/ IGF様シグナルの寿命への影響は、機能的に特異的なインスリンおよびIGF分子、IGF結合タンパク質(IGFBP )、プロテアーゼIGFBP、GH、複数の受容体、および異なる組織特異的発現を伴う細胞内シグナル伝達のいくつかのメカニズム(16)。
脊椎動物モデル
いくつかの変異体GH / IGF-1マウスが異なるターゲットで設計されました。 最新のモデルを以下に説明します。
マウススネルとエイムス。
SnellおよびAmesマウスは、それぞれPIT-1およびPROP-1遺伝子に変異を持つ2つのマウス系統です(17、18)。 タンパク質PIT-1とPROP-1は両方とも、GH、プロラクチン、甲状腺刺激ホルモンを産生する下垂体細胞の分化に必要であるため、両方のタイプのホモ接合変異マウスは3つすべてのホルモンを欠いています(18)。 これらのモデルは、平均余命の有意な増加(野生型マウスよりも42〜70%長い)、インスリン感受性の増加、および腫瘍頻度の低下を示しました(19、20)。 エイムズマウスのカロリーが制限されると、その寿命はさらに長くなります(21)。 これらの動物には3つのホルモンがありませんが、平均余命の増加は主にGH欠乏に依存することが示されています(22)。
点灯/点灯マウス
点灯/点灯マウスには、GH欠乏症と、GH放出ホルモン受容体(GHRHR)をコードする遺伝子の変異があります。 これらの動物は小人であり、脂肪組織が増加し、腫瘍発生率が低下し、平均余命は23〜25%増加しました(19)。
GH放出ホルモンノックアウト(GHRH-KO)マウス。
ノックアウトマウスGH放出ホルモン(GHRH-KO)は、野生型動物よりも43%(雌)と51%(雄)長く生存し、Amesマウスの多くの表現型特性、例えば、インスリン、血漿トリグリセリドおよびコレステロールレベルの減少、脂肪組織の増加、血漿レプチンおよびアディポネクチンレベルの上昇(23)。
GH受容体ノックアウトマウス(GHR-KO)
GH受容体ノックアウトマウス(GHR-KO)は、血清GHレベルが高く、IGF-1レベルが非常に低い。 また、このマウス系統は野生型よりも38〜55%長く生存し(24)、酸化ストレスの減少と致命的な腫瘍の発症の低下と遅延を示したことが報告されました(25)。 同様の結果がdf / KOマウスで観察され、GHR-KOとAmes dwarfsの2つのミスハンドラインを交差し、GHとGH受容体を欠き、平均余命を延長し続けました(26)。 野生のエイムス兄弟やd性マウスとは異なり、カロリー制限はGHR-KOマウスの寿命を延長しませんでした。これは、GH / IGF-1軸とカロリー制限が寿命を延長するための類似または部分的に重複するメカニズムを持っていることを示唆しています(27) 。
GH受容体拮抗(GHA)
GH / IGF-1システムを抑制したすべての動物モデルが平均寿命の延長を示すわけではありません。 マウスのGHA系統はその一例です。 1つのアミノ酸を置き換えることで生成されるGHAは、GHと同じ親和性でGH受容体に結合できますが、細胞内シグナル伝達は引き起こしません。 GHAマウスの平均余命は有意に増加しませんでした(28)。
IGF-1R +/–マウス
不活性なIGF-1受容体(IGF-1R-/-)を持つほとんどのマウスは出生時に死亡しますが、IGF-1受容体の変異対立遺伝子(IGF-1R±)のヘテロ接合体の動物は非常に低い血清IGF-1レベルを示しました、女性では約10%、平均寿命は33%長く、男性では16%です。 しかし、この研究では、野生型コントロールは19か月まで生存し、結果の解釈を危険にさらしました(29)。 別のIGF-1R±ラインの平均余命を評価するより最近の研究では、平均余命が5〜10%わずかに増加しましたが、女性のみでした(30、31)。 さらに、主なバックグラウンドのひずみは、いくつかのマウスモデルの寿命延長の程度に影響を与えるようです(32)。
脳特異的IGF1-R +/-
脳特異的IGF1-R +/-変異マウスは野生型よりも9%長く生存し、これは寿命の調節における神経系の対応する役割を強調しています(33)。
肝臓特異的IGF-1破壊マウス(LI-IGF-1-/-)。
IGF-1産生障害のマウス(LI-IGF-1-/-)は、IGF-1遺伝子の不活性化により、血清IGF-1レベルが非常に低く、血清GHレベルが高くなっています。 LI-IGF-1-/-マウスでは肥満が著しく減少し、その結果、体重は野生型マウスよりも25%低かった。 雌のLI-IGF-1-/-マウスのみが、対照マウスと比較して16%の平均余命の増加を示しました(34)。
パッパ-/-マウス。
Pappa-/-マウスは、妊娠関連血漿タンパク質A、PAPP-A、PAPPA、IGF結合タンパク質の特定のプロテアーゼの遺伝子のノックアウトを持っています。 このマウス系統の平均寿命は、野生型コントロールと比較して38%長くなりました。 パッパ-/-マウスは小人でしたが、血清グルコース、インスリン、IGF-1、およびGHレベルは野生型コントロールのものと変わらず、PAPPAが主にオートクリンまたはパラクリンレベルで作用することを示唆しました。 平均寿命の延長に加えて、Pappa-/-マウスは腫瘍の発生率が低く、年齢に関連した変性病変を示しました(35、36)。
IRS中断(IRS1-/-)マウス。
IRS-1およびIRS-2は、インスリンおよびIGF-1シグナル伝達の重要なメディエーターです。 IRS1-/-マウスはインスリン抵抗性であり、主に筋肉組織におけるインスリンシグナルの伝達に欠陥があり、野生型よりも約30%短く、野生型動物と比較して平均寿命が18%長いのは雌のみでした(37 ) )
IRS2-/-マウスもインスリン抵抗性でしたが、IRS1-/-マウスとは異なり、肝臓、脂肪組織、骨格筋など、より多くの組織でインスリンシグナル伝達障害を示しました。 これらのマウスは糖尿病を発症し、その平均寿命は野生型マウスおよびIRS2±マウスよりもはるかに短かった。 IRS2 +/-マウスは、野生型マウスと比較してインスリン感受性が改善され、平均余命が長くなりました(+ 18%)。 さらに、脳特異的マウスIRS2±およびIRS2-/-は、インスリン抵抗性であることが報告されており、それぞれ野生型コントロールよりも18および14%長く生存していました(38)。
KLOTHO改変マウス。
KLOTHOタンパク質は、おそらく受容体/リガンド相互作用を破壊することにより、インスリンおよびIGF-1シグナル伝達を阻害します。 KLOTHO過剰発現マウスは正常なサイズであると報告されており、男性ではインスリン抵抗性が発現し、男性と女性の両方の平均余命は有意に増加しました(それぞれ+18および+ 30%)(39、40)。
P66shc破壊マウス(P66shc-/-)。
P66shcは、MAPK経路を活性化することにより、受容体後のIGF-1シグナル伝達を媒介するタンパク質です。 P66shc-/-マウスの表現型は正常でしたが、野生型コントロールよりも28%長く生存していました(41)。 しかし、これらのデータは最近の研究で確認されていません(42)。
老化と寿命におけるGH / IGF-1 /インスリンシグナル伝達の役割は、これらの動物モデルのすべてで深く研究されています。 無脊椎動物では、平均寿命に対するIGF-1 /インスリン経路の抑制の効果は明白で有意でしたが、マウスモデルではこの効果は弱まり、IGF-1R±やP66shc-/-などの一部のケースでは再現性がありませんでしたマウス。 ただし、これらのモデルのほとんどは、循環IGF-1とインスリンのレベルの低下、インスリン感受性の増加など、長生きマウスに共通の特徴をいくつか示しています。これらは、癌の発生率を減らし、ストレス耐性を改善し、寿命を延ばす可能性があります。 。 IGF-1システムを混乱させる可能性のある遺伝的変化は、動物をより長期間健康に保ち、いくつかの加齢性疾患を遅延または緩和する可能性があります。 このプロセスでは、神経組織と脂肪組織が重要な役割を果たします。
さらに、IGF-1システムの抑制に介入して寿命にプラスの効果をもたらすために、寿命中の最適な時点を決定するための追加データが必要です。 igf f / f C57B l / 6マウスでは、IGF-1欠乏症が5か月齢から始まり、対照群と比較して寿命の終わりに病理を伴う臓器の数が減少した女性でのみ平均寿命が15%増加しました。 さらに、晩期IGF-1欠乏症(15ヶ月)は癌のリスクを減らしましたが、平均余命にプラスの効果はありませんでした(43)。 これらのデータは、平均寿命を延ばすための幼少期のIGF-1欠乏の重要性を強調しています。 一方、Mao et al。 (44)IGF-1受容体に対するモノクローナル抗体を18か月齢のCB6F1マウスに後期投与すると、女性の平均余命が9%延長し、健康のいくつかの側面が改善したことが最近報告されました。
長命の人々のIGF-1システム
百歳以上の人は、寿命の最も極端な値に達した長寿の生物学的決定要因を研究するための最良の人間モデルと考えられています(45)。
いくつかの研究では、長い肝臓の循環インスリンとIGF-1レベルを若い対照のレベルと比較しています(46)。
代謝の加齢に伴うリモデリングは、人口全体で発生する生理学的プロセスです。 加齢は、しばしば耐糖能の低下と関連しており、これはインスリン抵抗性の増加と関連しています(47)が、長命の人々には例外があります。 インスリン抵抗性は年齢とともに増加し、南イタリアに住む90歳以上の人では減少することがわかっています(48)。 実際、長命の被験者は、若い被験者よりも高いインスリン感受性と優れたベータ細胞機能を示しました。 この違いは、主要な人体測定および代謝因子にも依存していませんでした。 100歳の患者では、2時間の血漿グルコース濃度は高齢者(平均年齢78歳)よりも低かった。 長期肝臓では、インスリンを介したグルコース消費は正常血糖のグルコース摂取中の高齢者のコントロールよりも高く、この長期生存グループで耐糖能とインスリン作用が維持されていました(49、50)。 インスリンに対する最良の感度を確認する同様の結果が、他の長肝集団で観察されました(51、52)。
さらに、長い肝臓は、グルコース代謝だけでなく脂肪組織にもインスリンの保存された効果を示しました。 実際、インスリン注入は通常、脂肪分解の阻害と関連しているため、血漿中の遊離脂肪酸とトリグリセリドの濃度が大幅に低下しています。 長い肝臓では、脂肪分解中のインスリンの阻害活性は、コントロール参加者よりも高かった(平均年齢78歳)(50)。 百歳以上の人は、成人のコントロールと比較して交感神経緊張が低く、インスリンのより良い作用、したがって空腹時血漿インスリンの低レベルに関連している可能性があることに注意する必要があります(53、54)。
平均寿命に関するIGF-1システムに関するデータは、長命の被験者では依然として矛盾しています(46)。 パオリッソ等。 (55)高齢者と比較して、健康な長肝の血漿IGF-1 / IGFBP-3比の増加を説明した。 彼らは、この増加した比率がIGF-1のより高いバイオアベイラビリティを示していることを示唆し、それは長い肝臓でのインスリンの作用の改善に貢献しています。 ボナフェら。 (56)IGF-1受容体遺伝子の少なくともA対立遺伝子(G / A、コドン1013)を持つ被験者は、遊離IGF-1の血漿レベルが低く、長命の人々の間でより一般的だったと報告しました。 新井ら。 (57)日本人の長肝集団における血清IGF-1の比較的低いレベルについて述べた。 この集団では、IGF-1とIGFBP-3の両方の最低率が死亡率の増加と関連していました(58)。
これらの矛盾する結果は、おそらくIGFシステムの複雑さと登録人口の民族差を反映しています。 さらに、百歳以上の人は、しばしば若い被験者の対照群と比較されました。 したがって、これらの研究のほとんどで、両グループのIGF-1の違いが異なる平均余命と関連しているか、生理学的に年齢に依存したIGF-1の減少を反映しているかを結論付けることは不可能でした。 実際、長肝の研究にはいくつかの制限があります:(1)有病率の低さ(5〜10,000人の住民あたり1世紀)、(2)極端な年齢による衰弱(長肝のほぼ95%に少なくとも1つの無力症基準があります)、(3 )同年齢(45、59)の対照群が存在しない。 これらの制限のため、この人間モデルは、平均余命の調整に関与する可能性のある年齢関連変数の研究には適していません。
百歳以上の子孫は、人間の寿命と健康的な老化に関連する関連要因を決定するための別の興味深いモデルです。 さまざまな国での一貫した一連の観察は、長い肝臓の子孫が同じ人口統計グループの代表者よりも健康的であり(51、60、61)、彼らの年代(62)よりも生物学的に(表層的に)若いことを示唆しています。 一般に、これらの研究は、100歳以上の親relativeの方が長生きし、健康である可能性が高いことを示しています(60、63)。 さらに、長肝の子孫の研究には、同じ年齢の子孫で構成される適切な人口統計学的に選択された対照群があるという利点があります。 。 この戦略は、コホート効果を防ぐために重要です。 したがって、長い肝臓の子孫のモデルは、長い肝臓の研究で見られるいくつかの制限(希少性、弱さ、適切な制御の欠如)を克服することができます(60)。
いくつかの研究で、IGF-1 /インスリン系は、長肝の子孫および対応する対照群で特徴付けられました。
長い肝臓、長い肝臓の子孫、および同等のコントロールの子孫で実行される革新的なキナーゼ受容体活性化アッセイ(KIRA)を使用して測定したIGF-1の循環生物活性を評価しました。長肝および長肝の子孫は、対照群と比較して、IGF-1の循環生物学的活性が比較的低かった。興味深いことに、長肝の子孫におけるIGF-1の生物活性は、インスリン感受性に反比例していました(51)。
Suhら。 (64)ユダヤ人のアシュケナージ100歳以上の子孫および年齢に匹敵するコントロールの血清IGF-1レベルを評価した。女性の長い肝臓では、血清IGF-1のレベルはコントロール参加者よりも35%高かった。この違いは、IGF-1受容体シグナル伝達の減少に対する代償反応を示している可能性があります。さらに、ユダヤ人のアシュケナージ百歳者の存在は、IGF-1受容体遺伝子のヘテロ接合変異の過剰な存在と比較的高い血清IGF-1レベルを示し、家族の寿命のない対照群と比較してIGF-1受容体活性を低下させた。
長寿を研究するために、他の著者は90歳の兄弟姉妹とその子孫を調べました。ライデンの寿命に関する研究では、少なくとも2人のレポーター、兄弟姉妹、その子孫、およびコントロールとしての子孫のパートナーからなる421家族が選択されました。これらの集団では、血清グルコース、インスリン、およびトリグリセリドが健康な老化の最良のバイオマーカーでした(低グルコースおよびインスリンレベルは健康とみなされました)(65)。血流中のIGF-1 / IGFBP-3比が最も低い9歳の100歳者は、生存率の向上に関連していました(66)。 9歳の子孫は、パートナーと比較してより高いインスリン感受性を示したが、空腹時血清IGF-1およびIGFBP-3のレベルは両方の空腹群で観察された(67)。おもしろい24時間の総GH分泌は、コントロールと比較して子孫で28%減少しました(68)。
人間の長寿を研究するための別のアプローチは、家族の寿命の長寿命家族研究指標などの厳しい基準に基づいて、例外的な長寿と健康な老化のための家族構成要素を選択することです。これらの家族は、並外れた平均余命のために選択され、長寿の家族歴のない対照群と比較されました(69)。この集団では、IGF-1の血中濃度が信頼できる年齢関連のバイオマーカーであることが証明されました(70)。
ヒトの寿命におけるGH / IGF-1 /インスリンシステムの潜在的な役割を支持して、多くの遺伝学的研究があります。実際、いくつかの遺伝子座がIGF-1およびIGFBP-3の循環レベルに関連しており、加齢に影響を及ぼす可能性があることがわかっています(71)。 90歳以上で60歳未満の患者集団で行われた関連性のゲノムワイド解析は、インスリン/ IGF-1経路に関与する遺伝子の遺伝的変異とヒトの寿命の間の明確なリンクを示しました(72)。高齢者を対象とした前向き研究では、インスリン/ IGF-1シグナル伝達活性の低下を示す遺伝子プロファイルを持つ女性は、より長い寿命を示しました(73)。長命の個人の4つの独立したコホートでは、年齢とともに外因性3(G3R)GH受容体ホモ接合性の有病率の線形増加が最近報告されています。 d3 / d3遺伝子型の存在は、平均余命を約10年延長しました(74)。
IGF-1システムとカロリー制限
加齢の生物学で最も説得力のある観察結果の1つは、カロリーを制限して、いくつかの加齢性疾患を予防または遅延させ、哺乳類の平均寿命を延ばす能力です(75〜78)。この現象の生物学的メカニズムは完全には明らかではありませんが、エネルギー代謝、内分泌系および酸化的損傷の対応する変化が潜在的に関与していることが示唆されました。
カロリー制限は、多くのホルモンの変化を引き起こします。げっ歯類では、飢withoutのないカロリー制限は、制限のレベルに比例してIGF-1とインスリンの循環レベルを抑制し、インスリン感受性とストレスと毒性に対する耐性を高め、癌のリスクを減らしました(79、80)。興味深いことに、カロリー制限中に野生型マウスで観察されたこれらの特性のほとんどは、前述のようにGH / IGF-1 /インスリンシグナル伝達の遺伝的障害のために長命であるマウスで報告された特性に似ています。
ヒトを対象としたランダム化臨床試験では、タンパク質摂取量を減らしない限り、カロリー制限によって血清IGF-1が減少しないことが示されています(81、82)。しかしながら、健康的な老化の認識されたバイオマーカーに対する栄養制限の効果を評価する最近のメタ分析は、血中のヒトIGF-1レベルの減少を示しました(83)。
食事制限中に、インスリンレベル、甲状腺ホルモン、レプチンレベルの低下、アディポネクチンおよびインスリン感受性の増加など、他のホルモンの変化が観察されました(85、86)。
このホルモンの適応は、いくつかのメカニズムを通じて寿命を延ばす上で重要な役割を果たします。
1)代謝率、細胞増殖および酸化ストレスの減少。実際、IGF-1は強力な成長因子であり、甲状腺ホルモンは基本的な代謝率と酸化的代謝の強力な刺激剤です。さらに、転写パターンは、成人の慢性的な中程度のカロリー制限により老化プロセスが遅くなり、細胞代謝が成長から維持および回復に切り替わることを示唆しています(84)。
2)老化細胞の蓄積を減らす。細胞の老化は、老化の主要なメディエーターであることが示されています(87)。時間が経つにつれて、タンパク質の恒常性が低下し、損傷が蓄積します。興味深いことに、老化細胞の蓄積を弱めることで、いくつかの加齢性疾患を遅らせることができます(88、89)。通常、mTOR経路は、栄養素、IGF-1、インスリンなどのいくつかのシグナルによって活性化されます(図2)。カロリー制限後に報告されたこの経路の規制緩和により、一部の生物の寿命が延びました。この効果は、明らかに、細胞保護的消化プロセスであるオートファジーの増加に続発しています。実際、オートファジーは古いまたは損傷した細胞成分を除去し、老化細胞の蓄積を防ぐことができる細胞処理プロセスです(90、91)。
3)炎症に対抗する。動物と人間の両方の食事介入は、老化プロセスを遅くし、弱い程度の炎症状態を弱める可能性があります(83、92)。栄養制限の抗炎症活性の根底にあるメカニズムは明確に定義されていません。この効果は、脂肪量と炎症性アディポカインの減少、ならびに食事介入中に観察される腸バリアの完全性の改善によると考えられています(93、94)。
カロリー制限中に被験者で観察された内分泌生化学的プロファイルは、平均寿命の調節における潜在的な役割を確認する100歳以上の人のそれに匹敵することに注意することは興味深いです。インスリン感受性の増加と血漿/血清IGF-1レベルの低下に加えて、いくつかの研究は、若い被験者と比較して、長生きの人々の循環アディポネクチンのレベルの増加と循環レプチンと甲状腺ホルモンのレベルの減少を示しています。
脂肪組織は、エネルギー代謝、脂質およびグルコースの恒常性、炎症反応の調節などの関連プロセスに関与するいくつかのサイトカインを産生する内分泌器官です。内臓脂肪組織は、代謝性疾患の発症に大きな役割を果たします(95)。加齢は、脂肪質量の増加と脂肪組織の再分布に関連しており、末梢皮下脂肪の損失と内臓脂肪の蓄積を特徴としています。高齢者では、おそらく脂肪細胞の機能、増殖、サイズ、および数の不均衡が原因で、アディポカインの分泌、合成、および機能の変化が報告されています(86)。アディポネクチンは、インスリン感作性、抗炎症性、抗アテローム生成性のサイトカインです。アディポネクチンは、いくつかの形態で血液中を循環します:三量体、六量体、高分子量マルチマー(HMW)および球状アディポネクチン(タンパク質分解切断型)。多量体HMWは、インスリン抵抗性と糖尿病に対する保護のためのアディポネクチンのより活性な形態であると考えられています(96)。循環アディポネクチンは、インスリン抵抗性、体重、血圧、血清脂質など、メタボリックシンドロームの側面と独立して否定的に関連しています。レプチンは主に皮下で産生され、内臓白色脂肪組織ではより少ない程度で産生されます。このサイトカインは、食物摂取、エネルギー消費、およびアテローム発生を調節します。レプチンは、食欲を減らし代謝を刺激することにより体重減少を促進し、炎症誘発性の性質を持っています(97)。多量体HMWは、インスリン抵抗性と糖尿病からの保護のためのアディポネクチンのより活性な形態である(96)。循環アディポネクチンは、インスリン抵抗性、体重、血圧、血清脂質など、メタボリックシンドロームの側面と独立して否定的に関連しています。レプチンは主に皮下で産生され、内臓白色脂肪組織ではより少ない程度で産生されます。このサイトカインは、食物摂取、エネルギー消費、およびアテローム発生を調節します。レプチンは、食欲を減らし代謝を刺激することにより体重減少を促進し、炎症誘発性の性質を持っています(97)。多量体HMWは、インスリン抵抗性と糖尿病からの保護のためのアディポネクチンのより活性な形態である(96)。循環アディポネクチンは、インスリン抵抗性、体重、血圧、血清脂質など、メタボリックシンドロームの側面と独立して否定的に関連しています。レプチンは主に皮下で産生され、内臓白色脂肪組織ではより少ない程度で産生されます。このサイトカインは、食物摂取、エネルギー消費、およびアテローム発生を調節します。レプチンは、食欲を減らし代謝を刺激することにより体重減少を促進し、炎症誘発性の性質を持っています(97)。血圧と血清脂質。レプチンは主に皮下で産生され、内臓白色脂肪組織ではより少ない程度で産生されます。このサイトカインは、食物摂取、エネルギー消費、およびアテローム発生を調節します。レプチンは、食欲を減らし代謝を刺激することにより体重減少を促進し、炎症誘発性の性質を持っています(97)。血圧と血清脂質。レプチンは主に皮下で産生され、内臓白色脂肪組織ではより少ない程度で産生されます。このサイトカインは、食物摂取、エネルギー消費、およびアテローム発生を調節します。レプチンは、食欲を減らし代謝を刺激することにより体重減少を促進し、炎症誘発性の性質を持っています(97)。
いくつかの研究では、長肝臓は若いコントロールよりも血漿アディポネクチン濃度が高く、レプチン濃度が低いことが報告されています(53、98-102)。アディポネクチンのすべての形態は、長い肝臓で有意に増加したが、多量体HMWは有意に高かった(99)。長い肝臓では、高アディポネクチン濃度はBMI、腎または心血管機能とは無関係であることが判明し、好ましい代謝表現型(HDL-Cのレベルが高い、糖化ヘモグロビン、インスリン、HOMA-IRおよびトリグリセリド)に関連していました(98、99)。アディポネクチン濃度の上昇は、長命の被験者(95歳以上)の子孫にも見られます(103)。
甲状腺ホルモンのレベルの低下は、明らかに長い肝臓の特徴です。マリオッティ等。 (104)健康な100歳以上の人は、他の対照群で観察されたものと比較して、血清TSHおよびFT3レベルが低く、血清rT3レベルが高かったと報告した。別のイタリアの長肝の集団では、総T4値は検査対象の60%で正常範囲を下回っていました(105)。バラノフスカヤ他百歳以上の人の血清T3レベルは、初期の高齢者や若い女性の血清T3レベルと比較して低かったと報告しました(52)。最近、672人の患者(52〜113歳)のイタリア人コホートの甲状腺機能プロファイルを特徴づけました。 FT3レベルとFT3 / FT4比の年齢に関連した減少が認められたが、FT4とTSHは年齢とともに増加する(106)。中国の100歳以上の家族では、甲状腺機能の低下(高TSHおよび低FT3濃度)は年齢に関連しているようであり、この表現型は遺伝性です(107)。
Corsonello et al。 (108)付随する近親者(子孫または/))が、長い肝臓の近親者ではない年齢が一致した対照よりも低い付随疾患、FT3、FT4、およびTSHレベルを有することがわかった。別のイタリア人集団では、同じ年齢の対照群と比較して、長い肝臓の子孫でより低いレベルの血漿FT4が観察された(60)。
一般に、長い肝臓は薄く(109)、健康的な食習慣を順守しています(110)。カロリー制限中の被験者と同様に、長い肝臓では、細胞の成長/代謝が遅くなり、シグナル伝達がよりよく制御され、オートファジーが増加しました。 100歳以上の人とその子孫のゲノム全体のDNAメチル化の分析を通じて、我々は、老化と寿命に潜在的に関与しているエピジェネティックに調節された遺伝子と経路を特定しました。我々の結果は、これらの集団がDNAメチル化状態のより良い保存、より遅い細胞成長/代謝、およびエピジェネティックなメカニズムを介したシグナル伝達のより良い制御によって特徴付けられたことを示しています(111)。寿命はミトコンドリア肥大による生体エネルギー機能を維持しますが、機能的な欠陥を補うことができます(112)。さらに、心筋梗塞の若い患者と健常な対照の両方と比較して、より高い血清ベクリン-1レベルによって証明されるように、健康な長肝は高レベルのオートファジーを持っています(113)。自食作用の増加は、例外的な寿命を持つ家族に属する被験者でも観察されました(114)。
対応する現象は炎症状態に関連して発生し、カロリー制限後の被験者では弱まり(115、116)、長い肝臓では高くなります(117-119)。加齢に伴い、軽度および慢性の炎症性病態(加齢性炎症)があり、心血管疾患、アテローム性動脈硬化、腫瘍、認知障害、変形性関節症、糖尿病などの多くの疾患の有病率が増加しています(120、121)。したがって、カロリー制限後の慢性炎症状態の弱体化は有益な効果です。 100周年の100歳の人は炎症の兆候を示しますが、同時にその有害な影響を免れているようです。この明白なパラドックスは、事実によって説明できます長い肝臓は、炎症性因子と抗炎症性因子の複雑で特異なバランスを持っているため、慢性炎症に対抗する効果のない反応を特徴とする、高齢者に比べて、より遅く、より限定的かつバランスのとれた炎症の発症につながります(120、121)。
これらのデータは、カロリー制限食中に長肝臓および哺乳動物に見られる寿命を延ばし、加齢性疾患を遅らせる一般的なメカニズムを示唆しています。
著者の意見。
前臨床モデルは、平均余命の調節におけるGH / IGF-1 /インスリンシステムの役割を考慮した一貫したデータを使用して、老化プロセスのより深い理解を提供しました。インスリン感受性の増加とインスリンレベルの低下が生存率の改善に関連することはよく知られていますが、GH / IGF-1軸の弱体化がヒトの平均余命の延長に有益な効果をもたらす可能性があることを示すいくつかの証拠があります。しかし、生涯を通じてIGF-1の最適なレベルがどのくらい長くなってより健康であるかはまだ不明です。さらに、IGF-1受容体感受性および受容体後経路の活性化は、長命の被験者を含むほとんどの研究で評価されていません。だからIGF-1の循環レベルの単純な用量では、IGF-1受容体シグナル伝達活性化の実際の状態を決定することはできません。このため、平均寿命を延ばし、健康な老化を促進するために、このシステムを目的とした薬理学的または環境的戦略を特定することは困難です。これらの側面の包括的な理解は、人間の老化を遅らせることを目的とした介入を特定し、リハビリテーション医学で使用するための主要な問題のままです。将来の研究では、長命の被験者におけるIGF-1調節遺伝子に関する機能的ネットワークの転写プロファイリングおよび分析を含め、IGF-1受容体シグナル伝達の機能状態を評価する必要があります。このため、平均寿命を延ばし、健康な老化を促進するために、このシステムを目的とした薬理学的または環境的戦略を特定することは困難です。これらの側面の包括的な理解は、人間の老化を遅らせることを目的とした介入を特定し、リハビリテーション医学で使用するための主要な問題のままです。将来の研究では、長命の被験者におけるIGF-1調節遺伝子に関する機能的ネットワークの転写プロファイリングおよび分析を含め、IGF-1受容体シグナル伝達の機能状態を評価する必要があります。このため、平均寿命を延ばし、健康な老化を促進するために、このシステムを目的とした薬理学的または環境的戦略を特定することは困難です。これらの側面の包括的な理解は、人間の老化を遅らせることを目的とした介入を特定し、リハビリテーション医学で使用するための主要な問題のままです。将来の研究では、長命の被験者におけるIGF-1調節遺伝子に関する機能的ネットワークの転写プロファイリングおよび分析を含め、IGF-1受容体シグナル伝達の機能状態を評価する必要があります。リハビリテーション医学における応用。将来の研究では、長命の被験者におけるIGF-1調節遺伝子に関する機能的ネットワークの転写プロファイリングおよび分析を含め、IGF-1受容体シグナル伝達の機能状態を評価する必要があります。リハビリテーション医学における応用。将来の研究では、長命の被験者におけるIGF-1調節遺伝子に関する機能的ネットワークの転写プロファイリングおよび分析を含め、IGF-1受容体シグナル伝達の機能状態を評価する必要があります。
結論
長い肝臓とカロリー制限食後の被験者との間の内分泌プロファイルに関して、顕著な類似性が記載されています。両方のモデルで観察された内分泌および代謝の適応は、細胞の成長/代謝の遅延、自然の生理学的貯蔵のより遅い損失、細胞増殖から再生活性への細胞代謝の移行、および老化細胞の蓄積の減少による平均余命の延長のための生理学的戦略となります。明らかに、これらのメカニズムは、少なくとも部分的に、GH / IGF-1 /インスリン系の調節によって媒介されます。
参照資料
- Franceschi C, Valensin S, Bonafè M, Paolisso G, Yashin AI, Monti D, et al.. The network and the remodeling theories of aging: historical background and new perspectives. Exp Gerontol. (2000) 35:879–96. 10.1016/S0531-5565(00)00172-8.
- Bartke A, Darcy J. GH and ageing: Pitfalls and new insights. Best Pract Res Clin Endocrinol Metab. (2017) 31:113–25. 10.1016/j.beem.2017.02.005
- Vitale G, Salvioli S, Franceschi C. Oxidative stress and the ageing endocrine system. Nat Rev Endocrinol. (2013) 9:228–40. 10.1038/nrendo.2013.29
- Vitale G, Cesari M, Mari D. Aging of the endocrine system and its potential impact on sarcopenia. Eur J Intern Med. (2016) 35:10–15. 10.1016/j.ejim.2016.07.017
- Reddy SSK, Chaiban JT. The Endocrinology of aging: a key to longevity “Great Expectations”. Endocr Pract. (2017) 23:1107–16. 10.4158/EP171793.RA
- Junnila RK, List EO, Berryman DE, Murrey JW, Kopchick JJ. The GH/IGF-1 axis in ageing and longevity. Nat Rev Endocrinol. (2013) 9:366–76. 10.1038/nrendo.2013.67
- Yakar S, Adamo ML. Insulin-like growth factor 1 physiology: lessons from mouse models. Endocrinol Metab Clin North Am. (2012) 41:231–47. 10.1016/j.ecl.2012.04.008 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Higashi Y, Sukhanov S, Anwar A, Shai SY, Delafontaine P. IGF-1, oxidative stress and atheroprotection. Trends Endocrinol Metab. (2010) 21:245–54. 10.1016/j.tem.2009.12.005 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, et al.. Insulin receptor isoforms in physiology and disease: an updated view. Endocr Rev. (2017) 38:379–431. 10.1210/er.2017-00073 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang RAC… elegans mutant that lives twice as long as wild type. Nature (1993) 366:461–4. 10.1038/366461a0 [PubMed] [CrossRef] [Google Scholar]
- Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans. Science (1997) 277:942–6. 10.1126/science.277.5328.942 [PubMed] [CrossRef] [Google Scholar]
- Tatar M, Kopelman A, Epstein D, Tu MP, Yin CM, Garofalo RS, et al.. A mutant Drosophila insulin receptor homolog that extends life-span and impairs neuroendocrine function. Science (2001) 292:107–10. 10.1126/science.1057987 [PubMed] [CrossRef] [Google Scholar]
- Clancy DJ, Gems D, Harshman LG, Oldham S, Stocker H, Hafen E, et al.. Extension of life-span by loss of CHICO, a Drosophila insulin receptor substrate protein. Science (2001) 292:104–6. 10.1126/science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N, Berman JR, Kenyon C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell (2003)115:489–502. 10.1016/S0092-8674(03)00889-4 [PubMed] [CrossRef] [Google Scholar]
- Broughton S, Partridge L. Insulin/IGF-like signalling, the central nervous system and aging. Biochem J. (2009) 418:1–12. 10.1042/BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM, Sheridan MA. Peripheral regulation of the growth hormone-insulin-like growth factor system in fish and other vertebrates. Comp Biochem Physiol A Mol Integr Physiol. (2012) 163:231–45. 10.1016/j.cbpa.2012.08.003 [PubMed] [CrossRef] [Google Scholar]
- Snell GD. Dwarf, a new mendelian recessive character of the house mouse. Proc Natl Acad Sci USA。 (1929) 15:733–4. 10.1073/pnas.15.9.733 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Role of the GH/IGF-1 axis in lifespan and healthspan: lessons from animal models. Growth Horm IGF Res. (2008) 18:455–71. 10.1016/j.ghir.2008.05.005 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci USA。 (2001) 98:6736–41. 10.1073/pnas.111158898 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Dwarf mice and the ageing process. Nature (1996) 384:33. 10.1038/384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Extending the lifespan of long-lived mice. Nature (2001) 414:412. 10.1038/35106646 [PubMed] [CrossRef] [Google Scholar]
- Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. Early life growth hormone treatment shortens longevity and decreases cellular stress resistance in long-lived mutant mice. FASEB J. (2010) 24:5073–9. 10.1096/fj.10-163253 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA, et al.. Growth hormone-releasing hormone disruption extends lifespan and regulates response to caloric restriction in mice. Elife (2013) 2:e01098. 10.7554/eLife.01098 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Assessment of growth parameters and life span of GHR/BP gene-disrupted mice. Endocrinology (2000) 141:2608–13. 10.1210/endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y, Hubbard GB, Lee S, Cortez LA, Lew CM, Webb CR, et al.. Reduced incidence and delayed occurrence of fatal neoplastic diseases in growth hormone receptor/binding protein knockout mice. J Gerontol A Biol Sci Med Sci. (2009) 64:522–9. 10.1093/gerona/glp017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gesing A, Wiesenborn D, Do A, Menon V, Schneider A, Victoria B, et al.. A long-lived mouse lacking both growth hormone and growth hormone receptor: a new animal model for aging studies. J Gerontol A Biol Sci Med Sci. (2017) 72:1054–61. 10.1093/gerona/glw193 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey KA, Bartke A. Targeted disruption of growth hormone receptor interferes with the beneficial actions of calorie restriction. Proc Natl Acad Sci USA。 (2006) 103:7901–5. 10.1073/pnas.0600161103 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Holland AN, Riders ME, List EO, Flyvbjerg A, Kopchick JJ. Deletion, but not antagonism, of the mouse growth hormone receptor results in severely decreased body weights, insulin, and insulin-like growth factor I levels and increased life span. Endocrinology (2003) 144:3799–810. 10.1210/en.2003-0374 [PubMed] [CrossRef] [Google Scholar]
- Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, et al.. IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice. Nature (2003) 421:182–7. 10.1038/nature01298 [PubMed] [CrossRef] [Google Scholar]
- Bokov AF, Garg N, Ikeno Y, Thakur S, Musi N, DeFronzo RA, et al.. Does reduced IGF-1R signaling in Igf1r+/− mice alter aging? Plos ONE (2011) 6:e26891. 10.1371/journal.pone.0026891 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. Longevity effect of IGF-1R+/− mutation depends on genetic background-specific receptor activation. Aging Cell (2014) 13:19–28. 10.1111/acel.12145 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mulvey L, Sinclair A, Selman C. Lifespan modulation in mice and the confounding effects of genetic background. J Genet Genomics (2014) 41:497–503. 10.1016/j.jgg.2014.06.002 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kappeler L, De Magalhaes Filho C, Dupont J, Leneuve P, Cervera P, Périn L, et al.. Brain IGF-1 receptors control mammalian growth and lifespan through a neuroendocrine mechanism. PLoS Biol. (2008) 6:e254. 10.1371/journal.pbio.0060254tt [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Svensson J, Sjögren K, Fäldt J, Andersson N, Isaksson O, Jansson JO, et al. Liver-derived IGF-1 regulates mean life span in mice. PLoS ONE (2011) 6:e22640 10.1371/journal.pone.0022640 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- フランチェスキC、パッサリーノG、マリD、モンティD. 21世紀の健康な老化モデルとしての100歳以上の人々:人類の遺産と世界規模のコンソーシアム(WWC100 +)の必要性。 Mech Aging Dev。 (2017)165(Pt。B):55–8。 10.1016 / j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G、Barbieri M、Kamenetskaya M、Paolisso G. GH / IGF-I / 100歳のインシュリンシステム。 Mech Aging Dev。 (2017)165:107–114。 10.1016 / j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrinsini E、Vichi S、Beck-Nielsen H、Laasko M、Paolisso G、Smith U.インスリン抵抗性研究(EGIR)の欧州グループ向け。 インスリン作用と年齢。 糖尿病(1996)45:947-53。 10.2337 / diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- パオリッソG、バルビエーリM、リゾMR、カレラC、ロトンディM、ボナフェM、他 インスリン抵抗性が低く、ベータ細胞機能が維持されていると、ヒトの寿命に貢献しますが、TH-INS遺伝子とは関係ありません。 Exp Gerontol。 (2001)37:149–56。 10.1016 / S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G、ガンバルデラA、Ammendola S、D'Amore A、バルビV、Varricchio M、他。健康な100歳以上の人の耐糖能とインスリン作用。 Am J Physiol。 (1996)270:E890-4。 10.1152 / ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G、ガンバルデラA、Ammendola S、Tagliamonte MR、Rizzo MR、Capurso Aなど..保存された抗脂肪分解インスリン作用は、健常な100歳以上の人のアテローム生成の少ない血漿脂質プロファイルと関連しています。 J Am Geriatr Soc。 (1997)45:1504-9。 10.1111 / j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G、Brugts M、Ogliari G、Castaldi D、Fatti L、Varewijck Aなど..低循環IGF-I生物活性は、人間の寿命に関連しています:100代の子孫の所見。 老化(2012)4:580–89。 10.18632 / aging.100484 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B、Wolinska-Witort E、Bik W、Baranowska-Bik A、Martynska L、Broczek K、他。長寿における神経内分泌状態の評価。 Neurobiol Aging(2007)28:774–83。 10.1016 / j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G、Manzella D、Barbieri M、Rizzo MR、Gambardella A、Varricchio M.健康な100歳以上の人のベースライン心拍変動:違い対 高齢者。 臨床。 科学 (1999)97:579–84。 10.1042 / cs0970579 [PubMed] [CrossRef] [Google Scholar]
- パオリッソG、タリアモンテMR、リッゾMR、カレラC、ガンバルデラA、バルビエリM、他 成長因子-1濃度のような低血漿インスリンは、高齢者のインスリン媒介グルコース取り込みの悪化を予測します。 J. Am。 Geriatr。 Soc。 (1999)47:1312–8。 10.1111 / j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G、Ammendola S、Del Buono A、Gambardella A、Riondino M、Tagliamonte MRなど..健康な100代の人々のインスリン様成長因子I(IGF-I)およびIGF結合タンパク質3の血清レベル:関係血漿レプチンおよび脂質濃度、インスリン作用、および認知機能を備えています。 J Clin Endocrinol Metab。 (1997)82:2204–9。 10.1210 / jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- ボナフェM、バルビエーリM、マルケギアニF、オリビエーリF、ラグノE、ジャンピエーリC、他。人類の寿命:寿命制御の進化的に保存されたメカニズムの手がかり。 J Clin Endocrinol Metab。 (2003)88:3299-304。 10.1210 / jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- 新井Y、広瀬N、山村K、清水K、高山M、海老原Y、et al ..百歳児における血清インスリン様成長因子-1:IGF-1の急速な代謝タンパク質としての意味。 J Gerontol A Biol Sci Med Sci。 (2001)56:M79–82。 10.1093 / gerona / 56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- 新井Y、高山M、権藤Y、稲垣H、山村K、中沢S、et al ..脂肪内分泌機能、インスリン様成長因子1軸、および100歳以上の例外的な生存。 J Gerontol A Biol Sci Med Sci。 (2008)63:1209-18。 10.1093 / gerona / 63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M、Jeune B、Fors S、Andersen-Ranberg K、Ankri J、Arai Yなど..5-COOP諸国の百歳以上の人々の脆弱性と関連要因。 老年学(2018)64:521–31。 10.1159 / 000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L、Ostan R、Cevenini E、Pini E、Scurti M、Vitale Gなど..健康な老化のモデルとしての100歳以上の子孫:イタリアの被験者に関するデータの再評価と包括的な概要。 老化(アルバニー。NY)。 (2016)8:1–11。 10.18632 / aging.100912 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P、Miglio R、Monti D、Mari D、Sansoni P、Caruso Cなど..片方または両方の親の寿命は、子孫の健康状態に影響しますか? Exp Gerontol。 (2013)48:395-400。 10.1016 / j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S、Pirazzini C、Bacalini MG、Gentilini D、Di Blasio AM、Delledonne Mなど..イタリアの半百歳以上の人とその子孫のPBMCのエピジェネティックな年齢が減少しました。 老化(2015)7:1159–70。 10.18632 / aging.100861 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Caselli G、Pozzi L、Vaupel JW、Deiana L、Pes G、Carru Cなど..サルデーニャの長寿における家族クラスタリング:系図的アプローチ。 Exp Gerontol。 (2006)41:727–36。 10.1016 / j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y、Atzmon G、Cho MO、Hwang D、Liu B、Leahy DJ、et al。機能的に重要なインスリン様成長因子I受容体変異 Proc Natl Acad Sci USA。 (2008)105:3438–42。 10.1073 / pnas.0705467105 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Deelen J、van den Akker EB、Trompet S、van Heemst D、Mooijaart SP、Slagboom PE、Beekman M.人間の寿命に遺伝子研究を活用するための健康な老化のバイオマーカーの採用。 Exp Gerontol。 (2016)82:166–74。 10.1016 / j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E、Rozing MP、Houwing-Duistermaat JJ、Slagboom PE、Beekman M、de Craen AJなど..ライデン長寿の非年齢者におけるインスリン様成長因子-1軸パラメーターと生存および機能状態との関連分析勉強。 老化(2015)7:956–63。 10.18632 / aging.100841 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP、Westendorp RG、FrölichM、de Craen AJ、Beekman M、Heijmans BTなど..中年のヒトインスリン/ IGF-1および家族の寿命。 高齢化(2009)1:714–22。 10.18632 / aging.100071 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E、Jansen SW、Akintola AA、Ballieux BE、Cobbaert CM、Slagboom PE、et al。成長ホルモンの分泌は、家族の寿命が長くなったヒトでは減少し、厳しく制御されています。 老化細胞(2016)15:1126–31。 10.1111 / acel.12519 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P、Sun FX、Andersen SL、Lee JH、Wojczynski MK、Sanders JLなど。また、非常に長寿命で豊かな家族は、健康寿命が延びています:長寿命の家族研究からの発見。 フロント公衆衛生(2013)1:38。 10.3389 / fpubh.2013.00038 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P、Thyagarajan B、Sun F、Honig LS、Schupf N、Cosentino Sなど..長寿家族研究の健康な高齢者における年齢に関連したバイオマーカー値の年齢と性別の分布。 J Am Geriatr Soc。 (2016)64:e189–94。 10.1111 / jgs.14522 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Teumer A、Qi Q、Nethander M、Aschard H、Bandinelli S、Beekman M、他。 老化細胞(2016)15:811-24。 10.1111 / acel.12490 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Deelen J、Uh HW、Monajemi R、van Heemst D、Thijssen PE、BöhringerS、et al。ヒトの寿命に関するGWASデータの遺伝子セット分析は、インスリン/ IGF-1シグナル伝達とテロメア維持経路の関連性を強調しています。 年齢(2013)35:235–49。 10.1007 / s11357-011-9340-3 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D、Beekman M、Mooijaart SP、Heijmans BT、Brandt BW、Zwaan BJなど..インスリン/ IGF-1シグナル伝達の減少と人間の寿命。 老化細胞(2005)4:79–85。 10.1111 / j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D、Govindaraju DR、Budagov T、Fradin D、Durda P、Liu Bなど.. GH受容体エクソン3欠失は、GH感度の増加と背の高い身長に関連する男性特有の例外的な寿命のマーカーです。 Sci Adv。 (2017)3:e1602025。 10.1126 / sciadv.1602025 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH、Colman RJ、Lopez M、Beasley TM、Aiken JM、Anderson RMなど。カロリー制限は、アカゲザルの骨格筋の加齢誘発細胞表現型を遅延させます。 Exp Gerontol。 (2011)46:23–9。 10.1016 / j.exger.2010.09.011 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- コルマンRJ、アンダーソンRM、ジョンソンSC、キャストマンEK、コスマトカKJ、ビースリーTMなど カロリー制限はアカゲザルの病気の発症と死亡を遅らせる。 科学(2009)325:201-4。 10.1126 / science.1173635 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- ウィルコックスDC、ウィルコックスBJ、トドリキH、縁石JD、鈴木M.カロリー制限と人間の寿命:沖縄人から何を学ぶことができますか? Biogerontology(2006)7:173–7。 10.1007 / s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA、Roth GS、Beasley TM、Tilmont EM、Handy AM、Herbert RLなど.NIA研究によるアカゲザルの健康と生存に対するカロリー制限の影響。 Nature(2012)489:318-21。 10.1038 / nature11432 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE、Kari FW、French J、Leininger JR、Travlos G、Wilson Rなど..食事制限により、インスリン様成長因子Iレベルが低下し、p53欠損マウスのアポトーシス、細胞増殖、腫瘍進行が調節されます。 がん研究 (1997)57:4667–72。 [PubMed] [Google Scholar]
- ベリガンD、パーキンスSN、ヘインズDC、ハーストSD。 成人発症のカロリー制限と絶食は、p53欠損マウスにおける自発的な腫瘍形成を遅らせます。 発がん(2002)23:817-22。 10.1093 / carcin / 23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM、Veldhuis JD、Rood J、Smith SR、Williamson D、Ravussin Eなど..非肥満男性および女性の成長ホルモン分泌に対するカロリー制限介入の効果。 老化細胞(2010)9:32–9。 10.1111 / j.1474-9726.2009.00530.x [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- フォンタナL、ビジャレアルDT、ダスSK、スミスSR、メイダニSN、ピッタスAG、他。非肥満男性および女性におけるIGF-1、IGF結合タンパク質およびコルチゾールの循環レベルに対する2年間のカロリー制限の影響:a無作為化臨床試験。 老化細胞(2016)15:22–7。 10.1111 / acel.12400 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D、Giovannetti E、Aquilano K.脂肪量とヒトの健康な老化のバイオマーカーに対する食事制限の影響。 加齢(2016)8:3341–55。 10.18632 / aging.101122 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM、Crosby SD、Lamming DW、JeBailey L、Krzysik-Walker S、Villareal DTなど..ヒトのカロリー制限はPI3K / AKT経路を阻害し、より若い転写プロファイルを誘導します。 老化細胞(2013)12:645-51。 10.1111 / acel.12088 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- 新井Y、小島T、高山M、広瀬N.メタボリックシンドローム、IGF-1、およびインスリン作用。 モル細胞エンドクリノール。 (2009)299:124–8。 10.1016 / j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM、Ravussin E.ヒトのカロリー制限に応じた内分泌の変化。 モル細胞エンドクリノール。 (2009)299:129–36。 10.1016 / j.mce.2008.10.014 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- フランチェスキC、ガラニャーニP、ヴィターレG、カプリM、サルヴィオーリS.炎症および「ガーブエージング」。 エンドクリノール代謝の動向。 (2017)28:199–212。 10.1016 / j.tem.2016.09.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M、Li B.加齢の医薬品介入。 Adv Exp Med Biol。 (2018)1086:235–54。 10.1007 / 978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ、Wijshake T、Tchkonia T、LeBrasseur NK、Childs BG、van de Sluis Bなど.. p16 Ink4a陽性の老化細胞のクリアランスは、加齢に伴う障害を遅らせます。 Nature(2011)479:232-6。 10.1038 / nature10600 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Derous D、Mitchell SE、Wang L、Green CL、Wang Y、Chen Lなど。カロリー制限の段階的レベルの影響:XI。 肝トランスクリプトームを使用したCRの延命効果を支える主な仮説の評価。 老化(2017)9:1770–824。 10.18632 / aging.101269 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Madeo F、Tavernarakis N、Kroemer G.オートファジーは長寿を促進できますか? Nat Cell Biol。 (2010)12:842-6。 10.1038 / ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E、Monti D、Franceschi C.炎症老化。 Curr Opin Clin Nutr Metab Care。 (2013)16:14–20。 10.1097 / MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN、Das SK、Pieper CF、Lewis MR、Klein S、Dixit VDなど。長期の中程度のカロリー制限は、細胞性免疫を損なうことなく炎症を抑制します:非肥満ヒトにおけるランダム化比較試験。 加齢(2016)8:1416–31。 10.18632 / aging.100994 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Ott B、Skurk T、Hastreiter L、Lagkouvardos I、Fischer S、BüttnerJ、他..肥満女性の腸透過性、炎症マーカー、および糞便微生物叢に対するカロリー制限の影響。 Sci rep。 (2017)7:11955。 10.1038 / s41598-017-12109-9 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X、Gomez-Ambrosi J、Rodriguez A、Becerril S、FrühbeckG、Catalan V.アディポカイン調節不全およびヒト肥満における脂肪組織の炎症。 Eur J Clin Invest。 (2018)48:e12997。 10.1111 / eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M、Liu F.アディポネクチンの多量体化、シグナル伝達および機能の調節。 Best Pract Res Clin Endocrinol Metab。 (2014)28:25–31。 10.1016 / j.beem.2013.06.003 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- BalaskóM、SoósS、SzékelyM、PéterváriE. Leptin and aging:エネルギーバランスの中心的規制における役割を特に重視したレビューと質問 J Chem Neuroanat。 (2014)61–62:248–55。 10.1016 / j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- 新井Y、中沢S、小島T、高山M、Abihara Y、Shimizu K、et al。 アディポネクチン濃度が高いことと、100代女性の長寿に対するその役割。 Geriatr Gerontol Int。 (2006)6:32–9。 10.1111 / j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W、Baranowska-Bik A、Wolinska-Witort E、Kalisz M、Broczek K、Mossakowska Mなど..ポーランドの100歳のアディポネクチンとそのアイソフォームの評価。 Exp Gerontol。 (2013)48:401-7。 10.1016 / j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C、Vitale G、Pagani S、Castaldi D、Ogliari G、Mari Dなど..新生児および100歳児の一般的なアディポカインの特徴。 J Pediatr Endocrinol Metab。 (2011)24:953–7。 10.1515 / JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B、Bik W、Baranowska-Bik A、Wolinska-Witort E、Szybinska A、Martynska Lなど..ポーランドの100歳の人々における代謝恒常性の神経内分泌制御。 J Physiol Pharmacol。 (2006)57(Suppl。6):55–61。 [PubMed] [Google Scholar]
- 三浦Y、橋井N、津本H、高倉D、太田Y、阿部Y、ら..日本の半超百年期における血漿タンパク質のNグリコシル化の変化。 PLoS ONE(2015)10:e0142645。 10.1371 / journal.pone.0142645 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G、Pollin TI、Crandall J、Tanner K、Schechter CB、Scherer PEなど。アディポネクチンのレベルと遺伝子型:ヒトの寿命の潜在的な調節因子。 J Gerontol A Biol Sci Med Sci。 (2008)63:447–53。 10.1093 / gerona / 63.5.447 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- マリオッティS、バルベシーノG、カトゥッリP、バルタレナL、サンソニP、ファグノニF、他。健康な100歳児における甲状腺機能の複雑な変化。 J Clin。 エンドクリノール代謝。 (1993)77:1130-4。 10.1210 / jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D、Russo MS、Di Stefano F、Receputo G、Rosso D、Rapisarda Rなど..健康な100歳の甲状腺機能。 アーチ・ジェロントール・ジェリアトル。 (1997)25:211–7。 10.1016 / S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R、Monti D、Mari D、Arosio B、Gentilini D、Ferri E、他。甲状腺機能の不均一性と、100歳以上および半超100歳以上の甲状腺機能低下症の影響:機能状態と死亡率との関連。 J Gerontol A Biol Sci Med Sci。 (2018)。 10.1093 /ジェローナ/ gly194。 [印刷前のEpub]。 [PubMed] [CrossRef] [Google Scholar]
- 彼Y、チェンX、ヤンD、シャオF、リューY、リンRなど..甲状腺機能は年齢とともに減少し、中国の100歳以上の家族の寿命に寄与する可能性があります。 JAGS(2015)63:1474-6。 10.1111 / jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A、Montesanto A、Berardelli M、De Rango F、Dato S、Mari Vなど.100歳以上の親族を含む、高齢および最古の被験者のグループにおけるFT3の年齢関連の変化の断面分析、ダウンレギュレートされた甲状腺機能には家族性の要素があり、寿命に関係していることを示しています。 加齢(2010)39:723–7。 10.1093 /エージング/ afq116 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- ペレイラダシルバA、マトスA、バレンテA、ギルÂ、アロンソI、リベイロRなど..ポルトガル人男性と女性の体組成評価と栄養状態の評価。 J Nutr Health Aging(2016)20:256–66。 10.1007 / s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- フランチェスキC、オスタンR、サントロA.栄養と炎症:百歳以上の人は、カロリー制限の食事をしている人に似ていますか? Annu Rev Nutr。 (2018)38:329–56。 10.1146 / annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D、Mari D、Castaldi D、Remondini D、Ogliari G、Ostan R、et al ..ヒトの老化と長寿におけるエピジェネティクスの役割:100代および100代の子孫におけるゲノム全体のDNAメチル化プロファイル。 年齢(2013)35:1961–73。 10.1007 / s11357-012-9463-1 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- スガルビG、マタレーゼP、ピンティM、ランサリーニC、アシオーネB、ジベッリーニLなど..ミトコンドリアの過灌流とオートファジー活性の上昇は、100歳以上の人の細胞の生体エネルギー保存の重要なメカニズムです。 老化(2014)6:296-310。 10.18632 / aging.100654 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E、Minoretti P、Sanchis-Gomar F、Pareja-Galeano H、Yilmaz Y、Garatachea Nなど..オートファジーの強化は人間の寿命に関連しますか? 健康な100歳以上の人では、オートファジーバイオマーカーbeclin-1の血清レベルが上昇します。 若返り解像度。 (2014)17:518-24。 10.1089 / rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- ラズ・Y、ゲレロ・ロスI、マイヤーA、スラグブームPE、アツモンG、バルジライN、他。活性化によって誘発されたオートファジーは、家族の寿命のCD4 + T細胞に保存されています。 J Gerontol A Biol Sci Med Sci。 (2017)72:1201-6。 10.1093 / gerona / glx020 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- Fontana L、Villareal DT、Weiss EP、Rasette SB、Steger-May Kなど カロリー制限または運動:冠状動脈性心臓病の危険因子への影響。 無作為化対照試験。 Am J Physiol Endocrinol Metab。 (2007)293:E197–202。 10.1152 / ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E、Redman LM、Rochon J、Das SK、Fontana Lなど..ヒトのカロリー制限の2年間のランダム化比較試験:健康期間と寿命の予測因子に対する実行可能性と効果。 J Gerontol A Biol Sci Med Sci。 (2015)70:1097-104。 10.1093 / gerona / glv057 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar]
- ブルーンスガードH、アンデルセンランバーグK、ジューンB、ペダーセンAN、スキンホジP、ペダーセンBK。 TNF-αの高い血漿濃度は、100歳以上の認知症に関連しています。 J Gerontol A Biol Sci Med Sci。 (1999)54:M357–64。 10.1093 / gerona / 54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S、Basile G、Merendino RA、Minciullo PL、Novick Dなど..血管疾患の兆候のない100歳以上の患者の循環インターロイキン18レベルの増加:長寿のもう1つの逆説? Exp Gerontol。 (2003)38:669–72。 10.1016 / S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R、Monti D、Bistoni O、Mazzone AM、Peri Gなど..ケモカイン、健康な高齢者および100歳以上の人のsTNF-RおよびsCD30血清レベル。 メカ 加齢開発 (2000)121:37–46。 10.1016 / S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C、Capri M、Monti D、Giunta S、Olivieri F、Sevini Fなど..炎症と抗炎症:老化と寿命に関する体系的な視点は、人間の研究から現れました。 Mech Aging Dev。 (2007)128:92-105。 10.1016 / j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- サルビオーリS、モンティD、ランサリーニC、コンテM、ピラジニC、バカリーニMGなど..免疫系、細胞老化、老化および寿命–炎症老化の再評価。 Curr Pharm Des。 (2013)19:1675–9。 10.2174 / 1381612811319090015
出所
ジョヴァンニ・ヴィターレ、ジュゼッペ・ペレグリノ、マリア・ボレリー、レオ・J・ホフランド。 長寿の変調におけるIGF-1システムの役割:論争と100世紀の視点からの新しい洞察フロントエンドクリノール(ローザンヌ)。 2019年 1027。