KDPV:活動電位( ソース )の生成中に1つのニューロンの近くの細胞外電位をモデリングした結果。 色は電位の振幅を示します。 この図は、さらに理解するために重要です。
脳を研究するための電気生理学的方法は、脳の電位を記録することに基づいています。 それらは非侵襲性に分類することができます-基本的に、脳波検査(EEG)、および侵襲性、例えば、脳波記録(ECoG)、パッチクランプ(パッチクランプ)または局所電界電位の登録(LPP =局所電界電位、LFP) 。 後者の場合、サイズが10〜100ミクロンの小さな電極が脳に直接注入され、その電位が記録されます。 哺乳類の脳の活動を細胞レベルで研究する、つまり個々の細胞の活動を測定するために、利用可能な非侵襲的方法を適用することはできません したがって、どの動物モデルでも、ヒトでも、非侵襲的方法は、個々のニューロンではなく、組織レベルでのニューロンの集合的活動に関する情報のみを提供します。
しかし、侵襲的な方法ではそれほど簡単ではありません。 1つのニューロンの活動を記録するには、電極をニューロンに非常に近づけ、パッチクランプで行われるように理想的にはセル内に配置するか、実際には困難で非常に難しい鋭い電極を使用する必要があります。 一方、サイズが〜10μmの細胞外電極は、ニューロンの密度が高く、細胞外溶液のイオン伝導率が高いため、5〜10個の細胞の活動電位を記録します。 したがって、個々のセルを登録するタスクは、セルの近くにある電極の密度を上げることで技術的に解決されます。 これに関して、現代の電気生理学は、電極の密度を高め、電極の数を増やし、サイズを小さくする方向に向かっています。 要件の中には、ノイズを減らすために登録サイトの近くで信号を増幅し、サイズを減らすためにマルチプレクサを配置する必要があります。 そのため、2016年にプレプリントで発表され、2017年にNatureに公開され、2018年には960電極用のCMOSテクノロジーで作られた新しい高密度ニューロピクセルサンプルがあり、そのうち384が同時記録に利用可能で、すでに市場に登場しています 。 1つの登録サイトのサイズは12ミクロンです。 サンプルの厚さは24ミクロンです。 さらに、高密度電極とアクティブな増幅により、人々は長い間働き始めましたが、ニューロピクセルは生産と販売に最初に到達したので、近い将来、この特定のテストはますます見つかるでしょう。

図 ニューロピクセル方式。 モノリシックシリコン基板には、960のサイトがあり、384チャンネルの完全なマルチプレクサとADインターフェイスがあります。
データ構造
グループ同期に関与する古典的な活動リズム (アルファ、ベータ、ガンマなど)に加えて、このようなサンプルを使用して取得したデータには、個々の細胞の活動電位も含まれます(AP =活動電位、AP、スパイク、癒着) 、記録上では、持続時間が1ミリ秒以下の短いピークのように見えます。
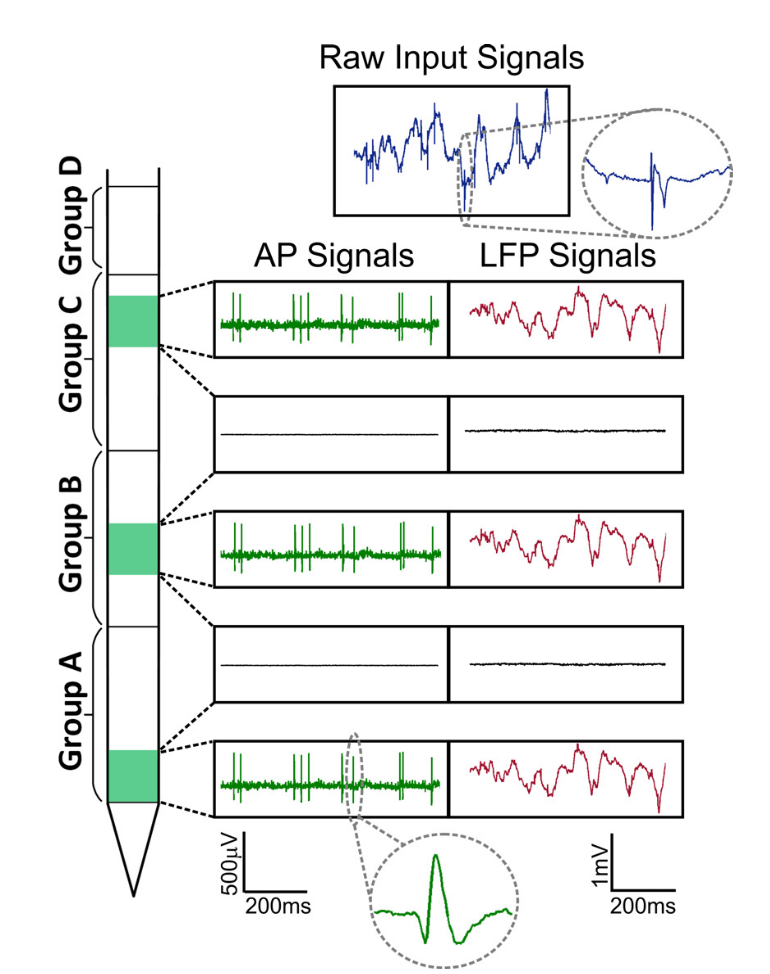
図 信号ニューロピクセル。 信号の2つの部分は区別されます:ローカルフィールドポテンシャル(LFP、最大300 Hzまで)と細胞活動(AP、300 Hzから)。
さらに、低周波局所場電位が通常振動のフレームワーク内で分析され、EEGのようにスペクトルまたはウェーブレット分析が使用される場合、細胞活動には個々の細胞の活動電位が含まれ、ノイズを背景にした個別のイベントで構成されます。 個々のセルのアクティビティを分離するタスクは、個別のスピーカーをスピーカーセットと区別する必要がある場合、カクテルパーティの問題のタスクに正式に減少します。 このようなサンプルのデータフローを評価すると、ビッグデータが表示されます。 スパイクの分析では、サンプリングはポイントあたり16ビット(uint16)からのデジタル化で30〜40 kHzで実行されます。したがって、1秒以内に100個の電極を記録すると、8 MBから重くなります。 同時に、実験は通常数時間続きますが、これはたった1営業日から数百ギガバイトに相当し、完全な研究には、たとえば10のそのような記録から必要です。 したがって、このサンプルの可能性は、データ分析に使用される機械学習アルゴリズムにも大きく依存します。
機械学習と細胞活動
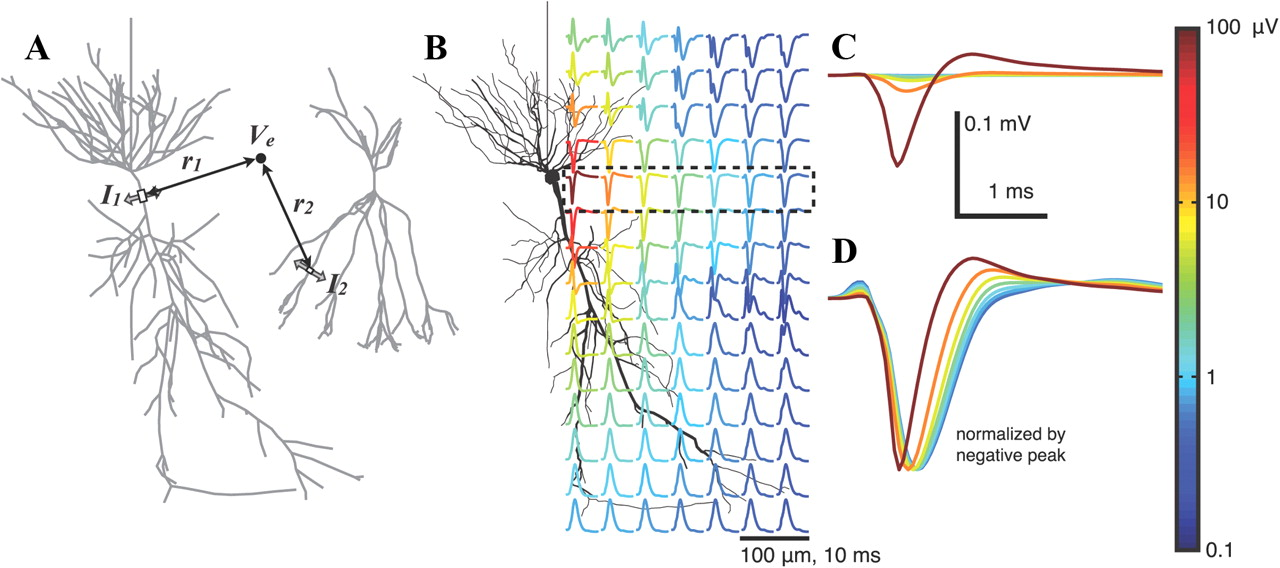
通常、細胞活動分析のパイプラインは、前処理、スパイクセグメンテーション、およびクラスタリングで構成されます。 研究のこの部分は、一般的にクラスター分析またはスパイクソートと呼ばれます。 300 Hzを超える他の生理学的リズムはなく、個々の細胞活動に関する情報のみが残っていると考えられているため、前処理として通常ローパスフィルタリング(> 300 Hz)が使用されます。 また、高密度サンプルでの前処理中に、50 Hzでのピックアップなどの相関ノイズを減らすことができます。 セグメンテーションは、多くの場合、単純なしきい値と見なされます。たとえば、ノイズの5標準偏差を超えるものはすべてイベントと見なすことができます。 流域セグメンテーションアルゴリズムのように、空間と時間の関連イベントを区別するために、2つのしきい値のセグメンテーションがソフトとハードのしきい値と共に使用されることがあります。マーカークラスターのクラスタリングでは、サンプルトポロジが考慮されます。 セグメンテーション後、各イベントの中心付近で1〜2ミリ秒続くウィンドウが取得され、このウィンドウ内のすべてのチャネルから収集された信号が、さらなるクラスタリングのサンプルになります。 このサンプルは、スパイク波形と呼ばれます。 異なるセルと登録サイトからの異なる距離は、波形が異なるという事実につながります(KDPVを参照)。 波形クラスタリングアルゴリズム自体は、EM、テンプレート一致検索、深層学習、および多くのバリエーションを使用します( githubのトピック )。 唯一の要件は、教師なしのトレーニングです。 しかし、1つの問題があります。 分析を最も効果的にするために、パイプラインにどのパラメーターを使用するかは、誰にもわかりません。 通常、クラスタリング後、アナリストは結果を手動で確認し、自由に変更を加えます。 したがって、分析の結果には、アルゴリズムのエラーと人的エラーの両方が含まれます。 そのため、客観的な検証の問題は未解決のままです。
パイプラインを検証する方法はいくつかあります。 まず、学習対象の外部条件を変更します。 たとえば、実験中に皮質の視覚部分を調べると、画像のテクスチャ、色、明るさを変更できます。 分析で、刺激に応じてその活動を変化させる細胞がある場合、あなたは幸運です。 次に、特定のチャネル遮断薬を使用するなどして、特定のタイプの細胞の活性を薬理学的に増強または低下させることができます。 その後、セルのアクティビティが増加/減少し、クラスタリングの違いがわかります。 ただし、時間の活動電位のプロファイルはイオンチャネルの反応速度によって完全に決定されるため、このような活動の変調は波形の変化にもつながります。 第三に、このデータセットのように、特定の細胞の活性をオプトジェネティックに、またはパッチピペットを使用して測定または誘導できます。 パッチ電極の大きなS / N比と安定性により、1つのセルのアクティビティに完全に自信があります。 概念的には、このパブリケーションは、パッチクランプを使用した検証データセットのアセンブリ専用でした。
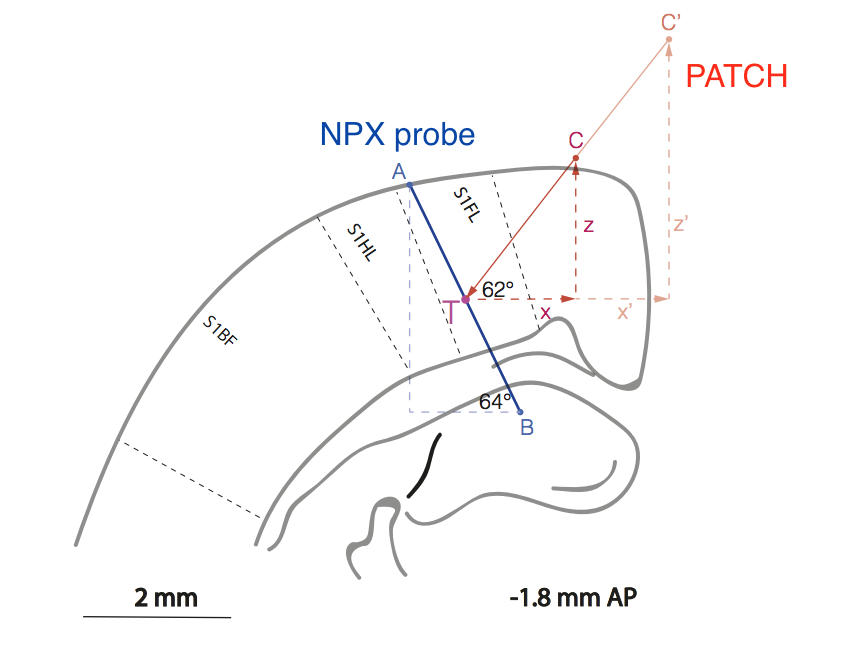
図 前足からの感覚情報の処理を担当するラット皮質領域内のサンプル(ラインAB)とパッチピペット(ラインC'CT)の相対位置の概略図(S1FL =感覚皮質1前肢)。
言うまでもなく、方法論的には、実験は非常に困難です。実験者は、視覚制御なしで大脳皮質内の2つの電極を10μmの精度で相対配置する方法を開発しなければならなかったからです。
スパイククラスタリングに対する電極密度の影響
登録サイトの密度を上げることがなぜそれほど重要なのですか? 類推として、EEG研究者は、特定のしきい値から、キャップ内の電極の数を増やしても、受信する情報の顕著な増加につながらないという事実を知っています。つまり、電極からの信号は、隣接する電極からの信号の線形補間とは少し異なります 誰かが、このしきい値はすでに30で、誰か50で、誰か100の電極で到達していると言います。 EEGを詳細に扱う人は修正できます。 しかし、細胞活動の場合、1つのサンプルの登録サイトの密度のしきい値はまだ知られていないため、高密度のサンプルの競争は続いています。 このため、Kampff Labチームは5x5μm2のサイトのサンプルを引き続き使用しており、このための予備データが投稿されています。 高密度電極を使用する専門家は、同じ場所のサンプルから分離できる個々の細胞の特定の数が登録サイトの密度が高いほど高いという予想を共有しています。 この効果は、同じ共著者による別の研究でよく例証されており、彼らは密なサンプルからサイトの一部のみを人為的に選択し、波形スパイクからPCA値へのtSNE変換後の結果のクラスターの品質を視覚的に評価しました。 これはクラスタリングの標準ではありませんが、依存関係を説明するのに適しています。 テストとして、Neuroseekerは20x20μm2のサイトで合計サイズ700x70μm2の128チャネルに作用しました。

図 TSNE over PCAダイアグラムは、サンプル上のサイトの密度を人為的に減らしながら、未加工の波形を示します。 作業現場は、各図の上に概略的に示されています。 サイト密度の増加に伴い、分離されたクラスターの数が正確に増加する様子が明確に示されています。Aが最高、Fが最悪です。
作品の本質は何ですか
Marques-Smith等において。 パッチクランプとサンプルの同時記録があります。 パッチクランプデータを使用して、科学者は活動電位の瞬間を見つけ、これらの瞬間を使用して、すでにサンプルにある波形をセグメント化および平均化しました。 その結果、彼らは、サンプル領域全体にわたって、時間と空間における活動電位の非常に高品質の分布を構築することができました。

図 左側には、パッチクリップ(黒)と最も近いNeuropixelsチャネル(青)で同時に細胞活動の痕跡があります。 中央-500個の個別サンプルとその平均。 右側にあるのは、サンプル領域全体および時間内の空間内の活動電位の分布です。
次に、細胞外波形のスパイクからスパイクへの変動に関する問題が発生します-はい、それは明白であり、考慮に入れなければなりません。 そして、彼らは、それらの高密度電極を使用して細胞膜に沿った活動電位の分布を追跡することが基本的に可能であることを示しますが、これは他のグループの研究ですでに示されています。 結論として、彼らは潜在的な共同研究者に神経生理学からのいくつかの基本的な質問を提供し、それらはデータセットの助けを借りて答えを試みることができ、細胞活動をクラスタリングするパイプラインを検証するためにデータセットを使用することも提供します。 後者は大胆な挑戦のように聞こえます。なぜなら、現在多くのクラスタリングアルゴリズムがあり、メソッド間の競争が非常に大きいからです。 すべての方法が、第一に、非常に多数のチャネルで機能するわけではなく、第二に、誰もが客観的に高品質のクラスタリングを提供できるわけではありません。
次は何ですか
まず、CMOSテクノロジーでも1300チャンネルのニューロシーカーの新しいバージョンが近づいています 。予備データはすでに利用可能です 。
第二に、2018年のFENS会議で発表されたアレン脳科学研究所からの別のデータセットを待っています。 同時に4(!)ニューロピクセルサンプルを使用して、さまざまな視覚刺激でマウス皮質の視覚セクションを研究します。 彼らはここで2018年の終わりに、二光子データ(これも非常に強力なデータセット)の隣に公開することを約束しましたが、今のところ何もありません。
第三に、細胞外電位を記録することから細胞をクラスター化するタスクは、私には美的に美しいようです。 マイクロエレクトロニクス、神経生理学、機械学習の方法を統合しています。 さらに、これには大きな基本的価値と応用価値があります。 この分野ではすでに独自の動物園を開発しているため、habrの聴衆は電気生理学の技術的料理、つまりクラスタリングアルゴリズムについて学ぶことに興味があると思います。 次に、これらのアルゴリズムに関するいくつかの質問を蓄積しました。そのようなデータセットはスキップできません。 したがって、次の部分では、標準的なKlustakwikから始めて、KlolosortまたはSpyking Circusのテンプレートメソッドを続行し、次に、他の誰よりも速く、より優れていることを非常に強く宣言する YASSのいくつかのアルゴリズムの分析に進みます。 ここにいくつかのクラスターのリストを持つgithubのトピック。 いくつかの質問を予想して、私は自分のアルゴリズムを開発する意味がありません。なぜなら、競争はすでに非常に大きく、多くのアイデアがすでに他の人によって実装され、テストされているからです。 しかし、向こう見ずな人がいる場合-私は喜んで貢献します。
提案や要望は受け入れられます。 ご清聴ありがとうございました!