1.なぜタンパク質が重要なのですか?
フリードリヒ・エンゲルスが言ったように、「生命はタンパク質体の存在の方法です。」 19世紀には、彼らはまだ遺伝情報の継承におけるDNAの役割については知りませんでしたが、フリードリッヒおじさんの声明はまだかなり真実です-それは私たちの細胞で主な仕事をするタンパク質です。 これには、構造の維持(細胞の形状)、化学触媒、運動機能(筋肉の収縮など)、および輸送(ヘモグロビンタンパク質が肺から組織へ酸素を運び、二酸化炭素を逆方向に運ぶ)と安定性を維持する複雑な調節機能が含まれます内部環境(タンパク質ホルモンやあらゆる種類の細胞内調節システムなど)やその他の多く。 一言で言えば、何かが私たちの体で起こった場合、タンパク質は必然的にそれに関与します(それらだけでなく)。
2.タンパク質とは?
化学的な観点から見ると、タンパク質は、さまざまな「側基」が結合している「主鎖」の同一ブロックを単調に繰り返すことからなる線形(非分岐)ポリマーです。 主鎖のブロックは非対称であるため、タンパク質のポリペプチド鎖全体に方向があり、ポリペプチド鎖のN末端とC末端が区別されます。
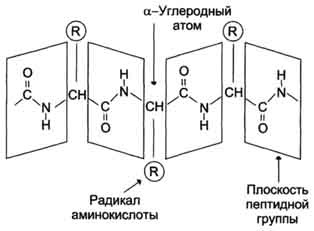
鎖の長さは70から1000モノマー(アミノ酸残基)以上で、高等生物の平均長は約500-600アミノ酸残基です。細菌の場合、この値は300-400残基よりも少なくなります。 合計で、バクテリアと人間で同じ自然の20の標準アミノ酸があります。つまり、20の異なる側基が主鎖から突き出ることができます。
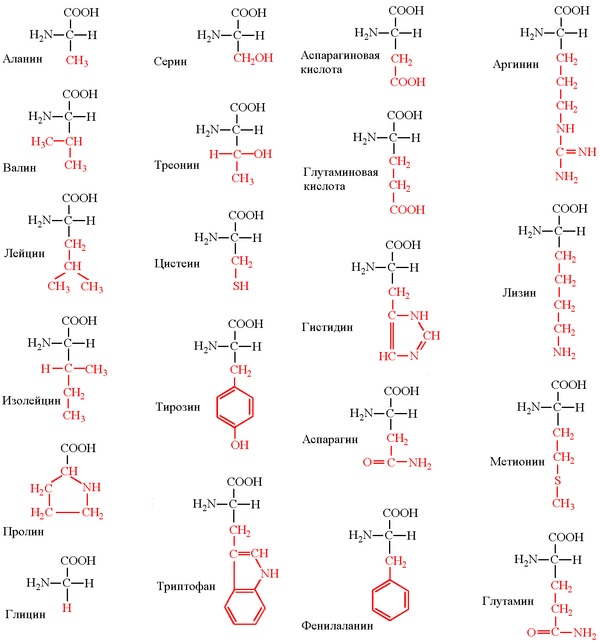
(ここで修正が可能です-リン酸化など、タンパク質合成後に一部の化学基を変更できます。ただし、これは別のアミノ酸とは見なされませんが、元のアミノ酸の変更の産物と見なされます。また、高等生物は2つの非標準アミノ酸を組み込むことができますが、これはまれなイベントですつまり、厳密に言えば22種類のアミノ酸があり、そのうち20種類は塩基性で、2種類はまれであり、さらにいくつかの側基は時々化学的に修飾できます)。
世代から世代へと、遺伝情報はDNAの形式で送信され、いわゆる「タンパク質コード領域」が含まれています。 これらの場所では、DNAは明確に(オタクにとって、オルタナティブスプライシングおよびRNA編集に正確)、このタンパク質の合成のためのアミノ酸の線形配列に関する情報がコード化されており、さらに、元々DNAにコード化された情報からタンパク質を合成できる対応するマシンがセル内にあります。
タンパク質は20種類の標準モノマーから構成される線形ポリマーであるため、その「一次構造」と呼ばれるものは、たとえば次のように文字列として簡単に表すことができます。
>小さなユビキチン関連修飾因子3前駆体[ホモサピエンス] MSEEKPKEGVKTENDHINLKVAGQDGSVVQFKIKRHTPLSKLMKAYCERQG LSMRQIRFRFDGQPINETDTPAQLEMEDEDTIDVFQQQTGGVPESSLAGHSF
これは、FASTA形式の小さなヒトタンパク質のアミノ酸配列であり、「>」で始まる最初の行はその名前を示し、その後に標準的なコーディング(たとえば、M-メチオニ、S-セリンなど、標準の20文字のみ) 1文字のコード)、左側はタンパク質のN末端、右側はそのC末端です。 タンパク質の長さは異なるため、異なるタンパク質の場合、ラインの長さは明らかに異なります。 すべての既知のタンパク質の配列は、次のパブリックドメインで見つけることができます: www.ncbi.nlm.nih.gov
3.タンパク質の構造
さて、彼らは一次構造を理解しましたが、タンパク質は拡張された線形の形で機能しますか? もちろん違います。 構造の観点から、タンパク質には球状、膜状、線維状のさまざまなクラスがあることに注意してください。 膜タンパク質は、その名が示すように、細胞膜にのみ存在します;その構造を安定させるには、特別な膜環境が必要です;このレビューではそれらを考慮しません。 繊維状タンパク質は、細長い繊維と同様に単純な規則的な構造を持ち、水に不溶であり、構造的機能を果たします(たとえば、髪はケラチンで構成され、天然絹タンパク質は繊維状タンパク質を指します)。 最近、無秩序なタンパク質のクラスが選ばれました-一定の三次元構造を持たないタンパク質、または他のタンパク質と相互作用するときに短時間だけそれを獲得するタンパク質。 実用的な観点から最も興味深いのは、考慮するタンパク質のクラスです。球状の水溶性タンパク質で、ほとんどのタンパク質はこのクラスに属します。
水中の線状ポリペプチド鎖は、複雑な三次元構造(小球)に自然に折りたたむことができ、この折りたたまれた形でのみタンパク質が化学触媒作用やその他の興味深い働きをします。 したがって、このレベルでのみタンパク質の仕組みが明らかになるため、タンパク質の3次元的な折りたたみを正確に知ることが基本的に重要です。
質問 :特定のタンパク質に対応する3次元構造はいくつですか?
回答 :1つ、小さな「無秩序な」ループの小さな移動度まで。 1つのシーケンスに2つの十分に異なる構造が対応する場合、これらはプリオンです。
質問 :タンパク質はなぜ3次元構造を1つしか持たないのですか?
回答 :化学触媒作用については、対応する化学基を厳密に定義された方法で空間に配置する必要があります。 これには剛性構造が必要です。 つまり、活性中心のアミノ酸の化学基を適切な場所に維持するために、タンパク質全体が硬直している必要があります(実際、多くのタンパク質は、相互に移動可能な2つ以上の硬直した部分で構成され、これはタンパク質の活性の調節 ( アロステリック調節 )に必要です。特定のシグナルがタンパク質酵素の化学活性をオンまたはオフにする可能性があります)。 構造を硬く安定させるために、自然は各タンパク質の構造が原子の特定のシステムのエネルギー最小値に対応し、この最小値が非常に深く、タンパク質が「飛び出さない」ことを確認しました。 他のすべての寄生構造にはより多くのエネルギーがあり、タンパク質は未だに天然構造に対応するエネルギー最小値に落ちます。
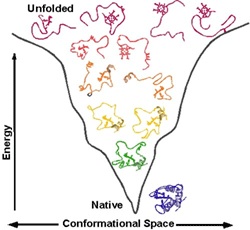
質問 :タンパク質の3次元構造は何を保持していますか?
答え :要するに、主に多数の非共有相互作用について。 原則として、タンパク質の化学基は、(1)水素結合、これらの基は主鎖といくつかの側基に存在し、(2)イオン結合は反対に帯電した側基間の静電相互作用、(3)ファンデルワールスを形成できます相互作用と(4)タンパク質の一般構造が依存する疎水性効果。 結論として、タンパク質には常に疎水性の芳香族残基があり、それらが極性水分子と接触することはエネルギー的に不利であり、互いに「くっつく」のが有利です。 したがって、タンパク質の折り畳み中に、疎水性基は水環境から押し出されて「くっついて」「疎水性コア」を形成しますが、極性基と荷電基は逆に水環境に入り、タンパク質小球の表面を形成する傾向があります。 また、(5)2つのシステイン残基の側鎖基は、それらの間でジスルフィド架橋を形成できます。これは、タンパク質を強固に固定する完全な共有結合です。
したがって、すべてのアミノ酸は、疎水性、極性(親水性)、正および負に帯電しています。 さらに、互いに共有結合を形成できるシステイン。 グリシンには特別な特性があります。他の残基の立体構造の可動性を厳しく制限する側基を持たないため、非常に「曲がる」ことができ、タンパク質鎖を展開する必要がある場所にあります。 プロリンでは、反対に、側基は主鎖に共有結合した環を形成し、その立体構造を堅く固定します。 プロリンは、タンパク質鎖を硬くて曲がらないようにする必要がある場合に見つけることができます。 多くの疾患はグリシンのプロリン変異に関連しているため、タンパク質構造はわずかに「浮いています」。
質問 :タンパク質の3次元構造についてどうやって知るのですか?
回答 :実験から、これは絶対に信頼できるデータです。
現在、タンパク質構造の実験的決定には、核磁気共鳴(NMR)、低温EM(電子顕微鏡)、およびタンパク質結晶のX線分析の3つの方法があります。
NMRを使用すると、溶液中のタンパク質の構造を特定できますが、非常に小さなタンパク質に対してのみ機能します(大規模な場合、デコンボリューションは不可能です)。

この方法は、タンパク質の3次元構造が1つだけであり、結晶中のタンパク質の構造が溶液中の構造と同一であることの一般的な証明に重要でした。 同位体ラベル付きのタンパク質を取得する必要があるため、これは非常に高価な方法です。
Cryo-EMは、タンパク質溶液の単純な凍結と顕微鏡検査で構成されています。 メソッドのマイナスは低解像度であり(分子の一般的な形のみが表示されますが、内部にどのように配置されているかは表示されません)、さらにタンパク質の密度が水/溶媒の密度に近いため、信号は高いノイズレベルでownれます。 この方法では、写真と統計を操作するためのコンピューター技術が積極的に使用され、ノイズから信号を引き出します。

タンパク質分子の何百万もの写真が選択され、クラスに対する分子の方向、基質の平均化、固有画像の生成、平均化の新しいラウンドなどに従って、収束するまで分類されます。 次に、さまざまなクラスの情報から、低解像度で分子の3次元の外観を復元できます。 粒子の内部対称性がある場合(たとえば、cryo-EMウイルス分析中)、各粒子は対称演算子に従って平均化することもできます-解像度はさらに向上しますが、X線回折分析の場合よりも悪化します。
X線回折分析は、タンパク質の構造を決定する主な方法です。 主な利点は、数十個のタンパク質から非常に大きな複合体の結晶を取得する可能性があることです(たとえば、これがリボソームの構造の決定方法-2009ノーベル賞)。 メソッドのマイナス-最初にタンパク質の結晶を取得する必要がありますが、すべてのタンパク質が結晶化したいわけではありません。
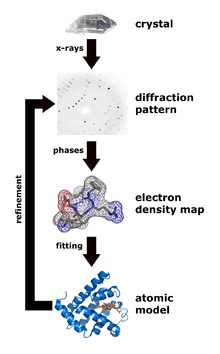
しかし、結晶が得られた後、X線回折によりタンパク質分子内のすべての(順序付けられた)原子の位置を明確に決定することが可能です。この方法は最高の解像度を提供し、最良の場合には個々の原子の位置を見ることができます。 結晶中のタンパク質の構造は、溶液中の構造に一意に対応することが証明されました。
慣例が有効になりました-実験的な物理的方法のいずれかを使用してタンパク質構造を決定した場合、構造はタンパク質構造データベース(Protein Data Bank-PDB、 www.pdb.org )のパブリックドメインに配置する必要があります。現在、90,000以上の構造があります(ただし、それらの多くは繰り返されます。たとえば、同じタンパク質と薬物などの異なる小分子の複合体です)。 PDBでは、すべての構造は、突然pdbと呼ばれる標準形式になります。 これは、構造の各原子が1行に対応するテキスト形式であり、構造内の原子の番号、原子の名前(炭素、窒素など)、原子が含まれるアミノ酸の名前、タンパク質鎖の名前(A、B、Cなど)を示しますそれがいくつかのタンパク質の複合体の結晶である場合)、鎖内のアミノ酸数、原点を基準としたオングストロームでの三次元原子座標、さらにいわゆる温度因子と人口(これらは純粋に結晶学的パラメーターです)。
ATOM 1 N HIS A 17 -12.690 8.753 5.446 1.00 29.32 N ATOM 2 CA HIS A 17 -11.570 8.953 6.350 1.00 21.61 C ATOM 3 C HIS A 17 -10.274 8.970 5.544 1.00 22.01 C ATOM 4 O HIS A 17 -10.193 8.315 4.491 1.00 29.95 O ATOM 5 CB HIS A 17 -11.462 7.820 7.380 1.00 23.64 C ATOM 6 CG HIS A 17 -12.551 7.811 8.421 1.00 21.18 C ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C ATOM 9 CE1 HIS A 17-14.492 7.301 9.267 1.00 27.01 C ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28.21 C ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N
次に、このテキストファイルのデータによると、モニター画面でねじれるタンパク質分子の美しい3次元構造をグラフィカルに表示できる特別なプログラムがあります。GuyDodsonが言ったように、「マウスで分子に触れる」(例: PyMol 、 CCP4mg 、古いRasMol ) 。 つまり、タンパク質の構造を見るのは簡単です。プログラムを入れて、PDBから目的の構造をロードし、自然の美しさを楽しんでください。
4.構造を分析する
だから、私たちは主なアイデアを理解しました:タンパク質は、多くの弱い相互作用の影響下で水溶液中で凝固し、特定のタンパク質の安定したユニークな三次元構造になり、この形でその機能を果たすことができる線形ポリマーです。 タンパク質構造の組織にはいくつかのレベルがあります。 上記で、私たちはすでに一次構造-行に書き留めることができるアミノ酸の線形配列に精通しています。
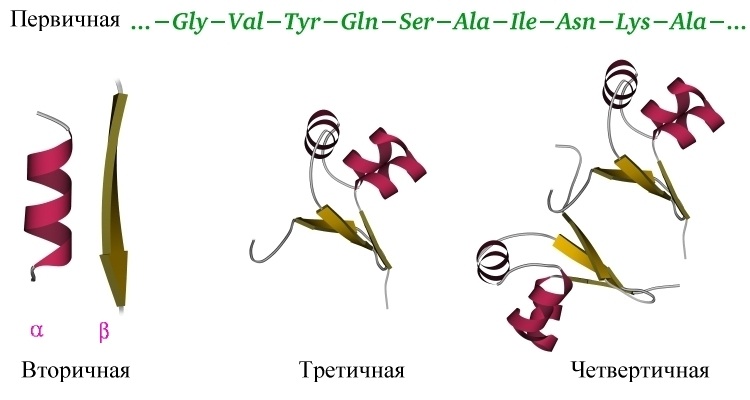
タンパク質の二次構造は、タンパク質の主鎖の原子の相互作用によって決まります。 前述のように、タンパク質の主鎖には水素結合のドナーとアクセプターが含まれているため、主鎖は何らかの構造を獲得できます。 より正確には、いくつかの異なる構造(詳細は異なる側基に依存します)、主鎖のグループ間で異なる代替水素結合の形成が可能であるためです。 構造は次のとおりです。アルファスパイラル、ベータシート(複数のベータストランドで構成される)。これらは平行および反平行のベータ回転です。 さらに、たとえばタンパク質ループの回転領域では、鎖の一部に顕著な構造がない場合があります。 これらのタイプの構造には、独自の確立された概略図の指定があります-らせんまたは円柱の形のアルファらせん、幅の広い矢印の形のベータ鎖。 二次構造は一次構造からかなり確実に予測でき( JPredが標準 )、アルファらせんが最も正確に予測され、ベータストランドにはオーバーレイがあります。
タンパク質の三次構造は、アミノ酸残基の側基の相互作用によって決まります。これはタンパク質の三次元構造です。 二次構造が形成され、これらのスパイラルとベータストランドがコンパクトな三次元構造にすべて収まるようになり、すべての疎水性側基がタンパク質小球の奥深くに静かに「くっついて」、疎水性コアを形成し、極性および荷電残基が突き出ることを想像できますタンパク質の表面を形成し、二次構造の要素間の接触を安定させます。 三次構造は、いくつかの方法で概略的に描かれています。 単純にすべての原子を描画すると、ポリッジが得られます(ただし、タンパク質の活性中心を分析するときは、活性残基のすべての原子だけを調べたいと思います)。
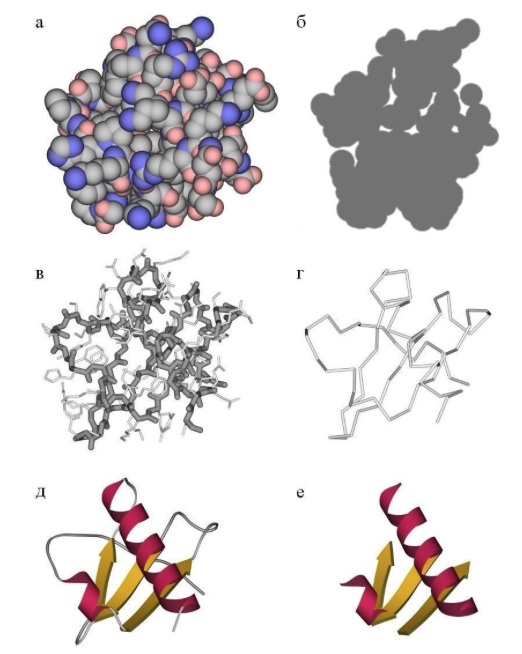
一般にタンパク質全体がどのように構造化されているかを知りたい場合は、主鎖の一部の原子のみを表示してその経過を確認できます。 あるいは、美しいスキームを描くことができます。原子の実際の配列の上に、二次構造の要素が概略的に描かれているので、一目でタンパク質の折り畳みを見ることができます。 一般的な概略図で構造全体を調べた後、活性中心の化学基を表示し、それらにすでに焦点を当てることができます。 タンパク質の三次構造を予測するタスクは重要であり、一般的なケースでは解決されませんが、特別なケースでは解決できます。 詳細-以下。
タンパク質の四次構造-はい、ありますが、すべてのタンパク質に真実があるわけではありません。 多くのタンパク質はそれ自体で機能し(モノマー、この場合、モノマーは単一の折り畳まれたポリペプチド鎖、つまりタンパク質全体を意味します)、その四次構造は三次構造です。 ただし、多くのタンパク質は、いくつかのポリペプチド鎖(サブユニットまたはモノマー-二量体、三量体、四量体、多量体)で構成される複合体でのみ機能します。そのようないくつかの別々の鎖のアセンブリは、四次構造と呼ばれます。 最も一般的な例は、4つのサブユニットで構成されるヘモグロビンです。私の意見で最も美しい例は、11の同一のサブユニットで構成される細菌タンパク質TRAPです。
5.計算タスク
タンパク質は数千の原子からなる複雑なシステムであるため、タンパク質の構造にコンピューターを使用しないと理解できません。 多くの問題があり、両方とも許容レベルで解決され、まったく解決されていません。 最も関連性の高いものをリストします。
一次構造のレベルでは 、類似のアミノ酸配列を持つタンパク質の検索、それらからの進化ツリーの構築などは、バイオインフォマティクスの古典的なタスクです。 メインハブはNCBI-国立バイオテクノロジー情報センター、 www.ncbi.nlm.nih.govです。 BLASTは、同様の配列を持つタンパク質の検索に標準的に使用されます: blast.ncbi.nlm.nih.gov/Blast.cgi
タンパク質溶解性の予測。 重要なのは、動物のゲノムを読み取り、そこからタンパク質の配列を決定し、これらの遺伝子を大腸菌またはバキュロウイルス発現システムに移すと、これらのシステムで発現した場合、タンパク質の約3分の1が正しい構造に折り畳まれないことが判明したということです、そして結果として、不溶性になります。 大きなタンパク質は、実際には独立した「ドメイン」で構成されており、各ドメインはタンパク質の自律的な機能部分(その機能の1つを担う)を表し、多くの場合、遺伝子から別のドメインを「切り取る」ことにより、可溶性タンパク質を取得してその構造を決定することが可能です彼と実験を行います。 人々は機械学習(ニューラルネットワーク、SVM、および他の分類器)を使用してタンパク質の溶解度を予測しようとしますが、それは非常に不十分です(Googleはクエリ「タンパク質溶解度予測」で多くのことを示します-多くのサーバーがありますが、私の経験ではすべてがうんざりします私のリスに)。 理想的には、これらの非常に可溶性のドメインがタンパク質内のどこにあるのかを確実に言うサービスを見てみたいので、それらを切断して操作することができます-そのようなサービスはありません。
二次構造レベル -一次( JPred )によるその二次構造の予測
三次構造レベルで -同様の三次元構造を持つタンパク質を検索します ( DALI 、 en.wikipedia.org/wiki/Structural_alignment )、
特定のサブ構造による構造を検索します。 たとえば、私は宇宙の活動中心の3つのアミノ酸の配列を持っています。 同じ相対位置に同じ3つのアミノ酸を含む構造を見つけたい、または突然変異によって目的のアミノ酸を正しい方法で配置できるタンパク質構造を見つけたい。 (google「タンパク質の部分構造検索」)
3次元構造の潜在的な移動性の予測、可能な立体構造の変化-ノーマルモード解析、 ElNemo 。
四次構造のレベルでは 、2つのタンパク質の構造がわかっていると仮定します。 それらは複合体を形成することが知られています。 複合体の構造を予測します(たとえば、これらの2つのタンパク質が形状マッチングによって相互作用する方法を決定します)。 Google「タンパク質間ドッキング」
6.タンパク質構造の予測
この計算上の問題は別のセクションで取り上げました。なぜなら、それは素晴らしく、基本的であり、一般的なケースでは解決できないからです。
タンパク質を取り、完全に解いて水に入れると、数ミリ秒から数秒で元の状態に折りたたまれることが実験的にわかっています(この症状は、少なくとも病理学的な小さな球状タンパク質には当てはまります)。 これは、タンパク質の3次元構造を決定するために必要なすべての情報が暗黙的にそのプライマリシーケンスに含まれていることを意味するため、in silicoのアミノ酸配列によってタンパク質の3次元構造を予測する方法を学びたいです! ただし、一般的な場合のこの問題はこれまで解決されていません。 問題は何ですか? 実際には、プライマリシーケンスでは、構造を構築するために明示的な情報は必要ありません。 第一に、主鎖の立体配座に関する情報はありません-しかし、立体的な理由で多少制限されていますが、かなりの可動性があります。 さらに、各アミノ酸の各側鎖は異なる立体配座をとることができます。アルギニンなどの長い側鎖グループの場合、12を超える立体配座をとることができます。
どうする? 「分子動力学」と呼ばれ、あらゆる分子やシステムに適した、Habrachiansに知られている非常に一般的なアプローチがあります。折り畳まれていないタンパク質を取り、すべての原子にランダムな速度を割り当て、原子間の相互作用を考慮し、折り畳まれたタンパク質に対応する安定状態になるまで繰り返します。なぜこれが機能しないのですか?現代のコンピューティング能力により、水に入れられたタンパク質であるクラスターの数か月の操作で数千個の原子のシステムで数十ナノ秒を数えることができるからです。タンパク質の折りたたみの時間はミリ秒以上です。つまり、十分な計算能力がなく、ギャップは数桁です。しかし、数年前、アメリカ人は突破口を開いた。ベクトルコンピューティング向けに最適化された特別なハードウェアを使用し、ハードウェアレベルでの最適化の後、マシンの動作の数か月にわたって、非常に小さなタンパク質と丸まったタンパク質のミリ秒までのダイナミクスを計算しました。実験的に決定された(http://en.wikipedia.org/wiki/Anton_(computer))!しかし、勝利を祝うには時期尚早です。彼らは非常に小さなもの(そのサイズは平均タンパク質の5〜10倍小さい)と、折りたたみが研究された古典的なモデルタンパク質である最も速く折りたたむタンパク質の1つを取りました。大きなタンパク質の場合、計算時間は非線形に増加し、数年かかります。つまり、まだやるべきことがあります。Rosettaで
実装された別のアプローチ。彼らはタンパク質配列を非常に短い(3-9残基)フラグメントに分解し、これらのフラグメントのコンフォメーションがPDBにどのように存在するかを調べ、その後すべての場合にモンテカルロを起動し、何が起こるかを確認します。時にはそれが良いことが判明することもありますが、私の場合、クラスターの操作の数日後、あなたは愚かな質問が発生するようなドーナツを手に入れます。
手動モデリング用のツールもあります。二次構造を予測し、手動でねじって、最適なスタイルを見つけることができます。一部の優秀な人々はおもちゃFoldItをリリースしました、タンパク質を模式的に表し、パズルを組み立てるように積み重ねることができます(構造に興味がある人のために-お勧めします!)。CASPと呼ばれるタンパク質予測のための絶対に公式な競争があります。肝心なのは、実験者がPDBに類似体を持たない新しいタンパク質構造を決定すると、それをすぐにPDBにアップロードせず、このタンパク質の配列をCASP予測コンテストに提出することです。しばらくして、誰もが予測モデルを完成したとき、実験者は実験的に決定されたタンパク質構造をレイアウトし、予測因子がどれだけうまく機能しているかを確認します。最も興味深いのは、科学者ではなく、FoldItプレイヤーがCASPを何らかの形で獲得したことです。タンパク質の構造をモデリングし、タンパク質の構造をより正確に予測する専門家。しかし、これらの成功でも、タンパク質の構造を予測する問題が解決されていると述べることはできません-モデルは実際の構造から非常に遠いことが非常に多いです。
これらはすべて、ab initioタンパク質モデリングに関連しています。構造に関するアプリオリ情報がない場合。ただし、特定のタンパク質のPDBには、既知の構造を持つ遠い親relativeが存在する状況が非常に頻繁にあります。相対的とは、類似の一次配列を持つタンパク質を意味します。一次配列の類似性が30%を超えるタンパク質では、主鎖の同じ折り畳みが起こると考えられています(ただし、一次配列で統計的に有意な類似性を示さないタンパク質でも同じ折り畳みが観察されました)。既知の構造を持つホモログ(類似タンパク質)の場合、「相同モデリング」、つまりタンパク質の配列を既知のホモログ構造に単純に「プル」し、エネルギーを最小化して問題を解決することができます。そのようなシミュレーションは、非常に近い相同体で良好な結果を示します;相同体が遠いほど、誤差は大きくなります。相同モデリングのツール-モデラー、スイスモデル。
他の問題を解決することもできます。たとえば、特定の突然変異がタンパク質に導入された場合にどうなるかをシミュレートしてみてください。たとえば、タンパク質の表面の親水性アミノ酸を別の親水性アミノ酸に置き換えた場合、タンパク質の構造はまったく変化しません。疎水性コアのアミノ酸をサイズの異なる別の疎水性コアに置き換えると、タンパク質の折りたたみはほとんど変わらず、オングストローム画分にわずかに「移動」します。疎水性コアのアミノ酸を帯電したコアに置き換えると、タンパク質は単に「爆発」し、カールすることはできません。
すべてがそれほど悪くないように思えるかもしれませんし、タンパク質のフォールディングについて十分に理解しています。はい、私たちは何かを理解しています。たとえば、ある程度、ポリペプチド鎖の折り畳みの根底にある一般的な物理的原理を理解しています。それらは、PtitsynとFinkelsteinの素晴らしいタンパク質ブック「Protein Physics」で考慮されています。しかし、この一般的な理解では、「このタンパク質は丸まるか、丸まらないか」、「このタンパク質はどのような構造をとるのか?」、「所望の構造を持つタンパク質を作る方法は?」という質問に答えることができません。
これが実例の1つです。大きなタンパク質のドメインの1つをローカライズしたいのですが、これは標準的なタスクです。凝固して溶解する断片があります。つまり、生きた健康的なタンパク質です。しかし、最小限の部分を見つけて、遺伝子工学的手法を使用して両端から2〜3個のアミノ酸を除去し、そのような切断されたタンパク質を細菌で発現させ、その凝固を実験的に観察したいと思います。私たちはこのような小さな欠失を持つ数十個の構築物を作成し、そのような写真を見ます-完全に可溶性で生きているタンパク質は、完全に死んで折り畳まれていない3アミノ酸とは異なります。繰り返しますが、これは客観的な実験結果です。問題は、タンパク質の折りたたみを少なくともyes / noで予測して教えてくれる計算方法がないことです。折り畳みタンパク質と非折り畳みタンパク質の境界はどこにあるのか、クローンを作成し、多数のオプションを実験的にテストする必要があります。これは、タンパク質構造の理解が完全とはほど遠いという事実のほんの一例です。リチャード・ファインマンが言ったように、「私が再現できないもの、私は理解できない。」
だから、紳士、プログラマー、物理学者、数学者、私たちにはまだ取り組むべきことがあります。
この楽観的なメモで、私の休暇を取らせてください。この作品をマスターしたすべての人に感謝します。
サブジェクト領域に精通しているために、私は次の最小値をお勧めします
。1)「タンパク質物理学」プチシンとフィンケルシュタイン。 :材料アレクセイV.フィンケルシュタインは、オンラインで公開し、私は感謝を使用することをお勧めのほとんどphys.protres.ru/lectures/protein_physics/index.html(と私はいくつかの写真を引きずり出さ)
2)Patrushev、「人工遺伝子システム、」特に一部II「タンパク質工学」。 Djvu形式のトレントがあります
3)生物科学雑誌に掲載されている情報については、公式検索エンジンPubMed(www.pubmed.org)-「タンパク質工学」などについて読むように依頼する必要があります。